Las características del gas ideal: propiedades y comportamiento
Descubre las fascinantes propiedades y el intrigante comportamiento del gas ideal. En este artículo, exploraremos las características únicas que definen a este modelo teórico fundamental en la física y la química. Desde su simplicidad aparente hasta su sorprendente aplicabilidad en el mundo real, sumérgete en el apasionante universo del gas ideal y desvela los secretos que lo convierten en una herramienta invaluable en la comprensión de nuestro entorno. ¡Acompáñanos en este viaje de descubrimiento en Polaridades!
Características del comportamiento de un gas ideal: todo lo que necesitas saber
| Características del comportamiento de un gas ideal |
|---|
|
El comportamiento de los gases ideales: una guía completa
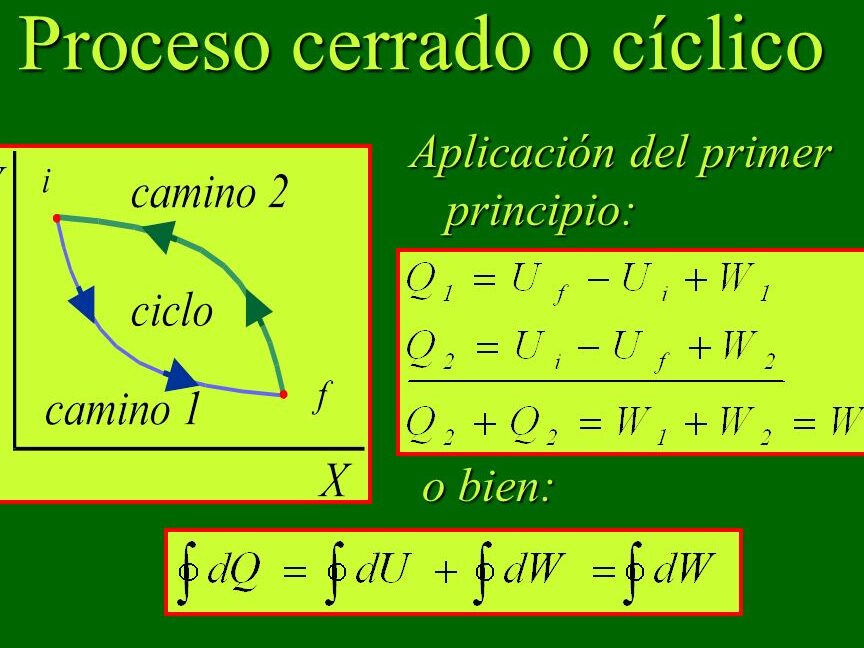
El comportamiento de los gases ideales sigue la ley de los gases ideales, que establece que a una temperatura constante, la presión de un gas es inversamente proporcional a su volumen y directamente proporcional a su temperatura en grados Kelvin. Para entender este concepto en profundidad, es importante tener en cuenta los siguientes puntos:
- Teoría cinética molecular: Esta teoría explica el comportamiento de los gases ideales mediante la idea de que los gases consisten en partículas en constante movimiento y colisión. Estas partículas no tienen volumen y no ejercen fuerzas de atracción entre sí.
- Constante de los gases ideales (R): La constante de los gases ideales, representada por la letra R, es una constante que relaciona la presión, el volumen y la temperatura de un gas en condiciones ideales. Su valor es 8.314 J/(mol·K) o 0.0821 atm·L/(mol·K).
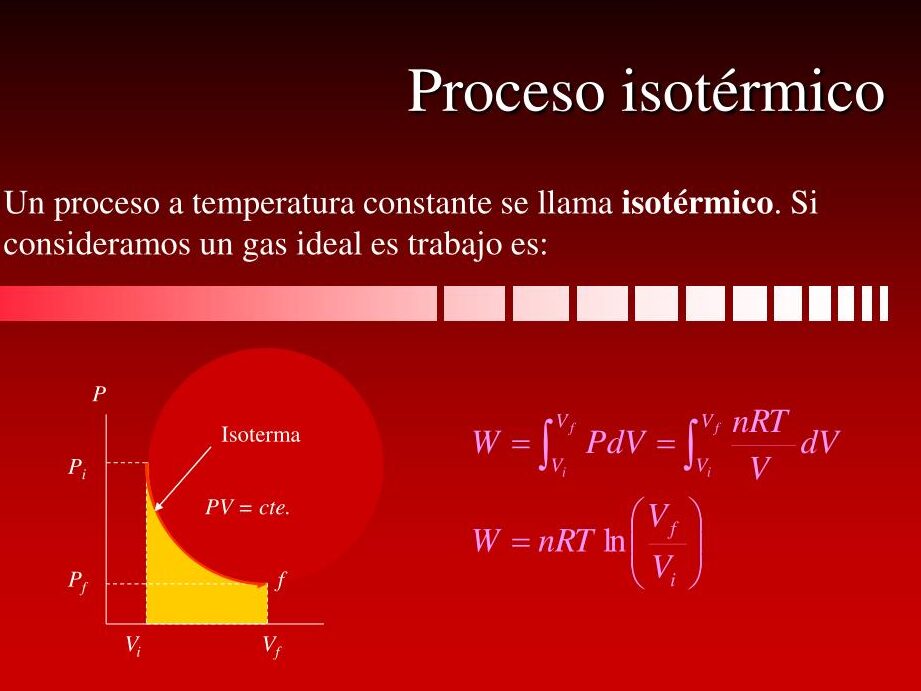
- La ecuación de los gases ideales: La ecuación de los gases ideales relaciona la presión (P), el volumen (V), la cantidad de sustancia (n) y la temperatura (T) de un gas en un sistema. Se expresa como PV = nRT, donde P es la presión en pascales, V es el volumen en metros cúbicos, n es la cantidad de sustancia en moles, R es la constante de los gases ideales y T es la temperatura en kelvin.
- Comportamiento a baja presión y alta temperatura: En estas condiciones, los gases ideales se comportan de manera similar al modelo ideal, ya que las partículas tienen mayor energía cinética y la distancia entre ellas es mayor, lo que reduce las interacciones entre ellas.
- Comportamiento a alta presión y baja temperatura: En estas condiciones, los gases ideales se desvían más del comportamiento ideal debido a que las partículas están más cerca unas de otras y las fuerzas intermoleculares comienzan a influir en su comportamiento.
Las características esenciales de los gases
| Característica | Descripción |
|---|---|
| Expansibilidad | Los gases tienden a expandirse y ocupar todo el volumen disponible en un recipiente. |
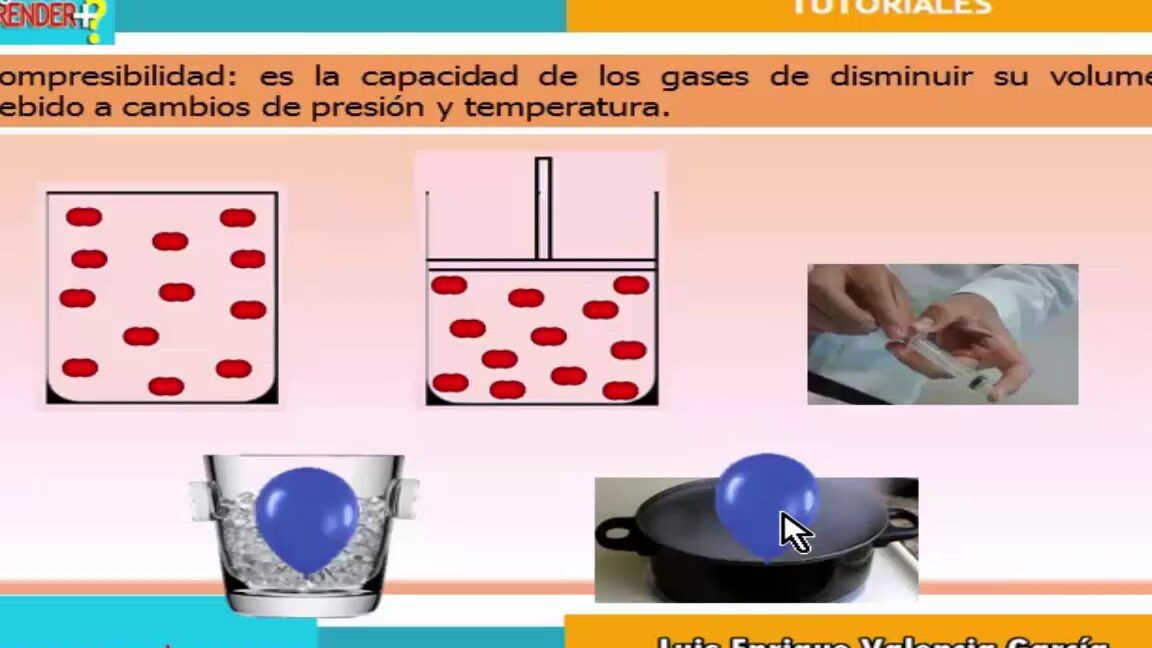
| Compresibilidad | Los gases pueden ser comprimidos reduciendo su volumen considerablemente. |
| Baja densidad | Los gases tienen una baja densidad en comparación con líquidos y sólidos. |
| Difusión y efusión | Los gases tienden a mezclarse de manera homogénea en un espacio y a difundirse a través de diferentes medios por su alta movilidad molecular. |
| Presión | Los gases ejercen presión sobre las paredes del recipiente que los contiene debido a la constante colisión de sus moléculas con dichas paredes. |
| Punto de ebullición y condensación | Los gases se convierten en líquidos al disminuir su temperatura, proceso llamado condensación, y se convierten en gases al aumentarla, proceso llamado ebullición. |
¡Y así es como el gas ideal se convierte en el amigo ideal de los científicos! ¡Siempre ocupando todo el espacio disponible y nunca quejándose! Ahora ya sabes por qué es tan genial y por qué no le gusta seguir reglas. ¡Sigue siendo tú, gas ideal, sigue siendo tú!











Post Comment