Clasificación de átomos: Guía completa para entender su estructura y propiedades
Los átomos son los bloques fundamentales de la materia, pero ¿alguna vez te has preguntado cómo se clasifican y qué determina sus propiedades? En este artículo, te presentaremos una guía completa sobre la clasificación de átomos, donde exploraremos su estructura y las fuerzas que influyen en sus propiedades. Descubre cómo los átomos se organizan en la tabla periódica y cómo esta clasificación nos ayuda a comprender el mundo que nos rodea. Prepárate para sumergirte en el fascinante mundo de la química y desvelar los secretos de los átomos. ¡Sigue leyendo y descubre más!
Cómo se clasifica la estructura del átomo
Clasificación de átomos: Guía completa para entender su estructura y propiedades
La estructura del átomo es fundamental para comprender su comportamiento y propiedades. En este artículo, te proporcionaremos una guía completa sobre cómo se clasifica la estructura del átomo.
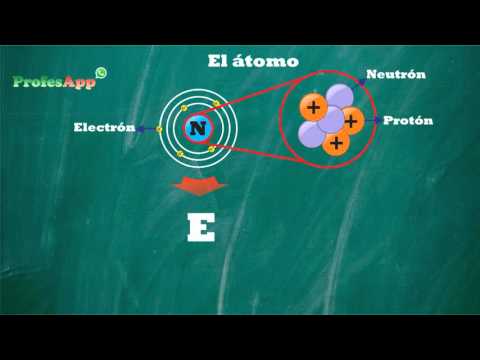
El átomo se compone de tres partículas subatómicas principales: protones, neutrones y electrones. Los protones tienen una carga positiva, los neutrones son neutros y los electrones tienen una carga negativa. Estas partículas se organizan en diferentes niveles de energía llamados capas electrónicas.
La clasificación de la estructura del átomo se basa en la distribución de electrones en las diferentes capas electrónicas. Los electrones se distribuyen en órbitas alrededor del núcleo atómico, siguiendo el principio de Aufbau, el principio de exclusión de Pauli y la regla de Hund.
El principio de Aufbau establece que los electrones se llenan en las capas más cercanas al núcleo antes de llenar las capas más externas. Esto significa que la primera capa electrónica solo puede contener hasta 2 electrones, la segunda capa puede contener hasta 8 electrones y así sucesivamente.
El principio de exclusión de Pauli establece que dos electrones en un átomo no pueden tener el mismo conjunto de números cuánticos. Esto significa que cada orbital puede contener un máximo de 2 electrones con espines opuestos.
La regla de Hund establece que cuando se llenan orbitales degenerados, los electrones tienden a ocupar cada orbital de forma individual antes de emparejarse. Esto significa que los electrones tienden a distribuirse de manera desigual en los orbitales de una misma capa electrónica.
La clasificación de los átomos se realiza en función del número de electrones que tienen en su última capa electrónica, también conocida como capa de valencia. Los átomos se clasifican en cuatro categorías principales: metales, no metales, metaloides y gases nobles.
– Los metales son átomos que tienden a perder electrones de su capa de valencia y formar cationes positivos. Son buenos conductores de electricidad y calor, son maleables y tienen brillo metálico.
– Los no metales son átomos que tienden a ganar electrones en su capa de valencia y formar aniones negativos. Son malos conductores de electricidad y calor, son frágiles y no tienen brillo metálico.
Qué son los átomos y cómo se clasifican
Clasificación de átomos: Guía completa para entender su estructura y propiedades
Los átomos son las unidades fundamentales de la materia. Son las partículas más pequeñas que conservan las propiedades químicas de un elemento. Aunque son extremadamente pequeños, los átomos están compuestos por diferentes subpartículas, llamadas partículas subatómicas. Estas partículas incluyen protones, neutrones y electrones.
La estructura de un átomo se compone de un núcleo central, que contiene protones y neutrones, y una nube de electrones que orbitan alrededor del núcleo. Los protones tienen carga positiva, los neutrones son neutros y los electrones tienen carga negativa. La cantidad de protones en el núcleo determina el número atómico y el elemento al que pertenece el átomo.
La clasificación de los átomos se basa en su número atómico y en su configuración electrónica. El número atómico define el número de protones en el núcleo y, por lo tanto, el elemento al que pertenece el átomo. La configuración electrónica describe cómo están distribuidos los electrones en los diferentes niveles de energía alrededor del núcleo.
Existen diferentes formas de clasificar los átomos. Una clasificación común se basa en la estructura electrónica y se divide en grupos y periodos. Los grupos representan las columnas verticales en la tabla periódica y están asociados con el número de electrones en el nivel de energía más externo. Por otro lado, los periodos representan las filas horizontales y están relacionados con el número de niveles de energía ocupados por electrones.
Además de la clasificación por grupos y periodos, los átomos también pueden clasificarse en metales, no metales y metaloides. Los metales son buenos conductores de electricidad y calor, mientras que los no metales son malos conductores. Los metaloides tienen propiedades intermedias entre los metales y los no metales.
Cuáles son los 4 tipos de átomos
Clasificación de átomos: Guía completa para entender su estructura y propiedades
En el estudio de la química, los átomos son los bloques fundamentales de la materia. Cada elemento químico está compuesto por átomos con características específicas. Los átomos se pueden clasificar en diferentes tipos según su estructura y propiedades. A continuación, te presentamos los 4 tipos de átomos más comunes.
1. Átomos neutros: Los átomos neutros son aquellos que tienen una carga eléctrica igual a cero. Esto significa que tienen el mismo número de protones en su núcleo que de electrones en sus orbitales. Los electrones están distribuidos en diferentes capas o niveles de energía alrededor del núcleo. Los átomos neutros son estables y no tienen tendencia a formar enlaces químicos con otros átomos.
2. Átomos iónicos: Los átomos iónicos son aquellos que han ganado o perdido electrones, adquiriendo una carga eléctrica positiva o negativa. Un átomo que ha perdido electrones se convierte en un catión con carga positiva, mientras que un átomo que ha ganado electrones se convierte en un anión con carga negativa. Los átomos iónicos son muy reactivos y tienden a formar enlaces químicos con otros átomos para adquirir estabilidad.
3. Átomos isótopos: Los átomos isótopos son aquellos que tienen el mismo número de protones pero difieren en el número de neutrones en su núcleo. Esto significa que tienen el mismo número atómico pero diferente número de masa. Los isótopos de un elemento tienen propiedades químicas similares, pero pueden tener diferentes propiedades físicas, como la masa y la estabilidad nuclear.
4. Átomos radioactivos: Los átomos radioactivos son aquellos que tienen núcleos inestables y emiten radiación para alcanzar la estabilidad. Estos átomos experimentan desintegración nuclear, lo que implica la emisión de partículas subatómicas y/o radiación electromagnética. Los átomos radioactivos pueden ser naturales o artificiales y se utilizan en diversas aplicaciones, como la medicina nuclear y la generación de energía.
¡Así que ahí lo tienes, amigo! Ahora eres todo un experto en la clasificación de átomos. Puedes impresionar a todos en tu próxima fiesta con tus conocimientos sobre electrones, protones y neutrones. ¡Nunca más te sentirás atómicamente perdido! ¡Adiós, átomos confusos, hola conocimiento científico!













Post Comment