Entalpía de vaporización del agua a 100°C: ¿Cómo se calcula y qué factores influyen?
La entalpía de vaporización del agua a 100°C es un concepto fundamental en la termodinámica y tiene implicaciones importantes en diversos campos, desde la química hasta la ingeniería. En este artículo, exploraremos cómo se calcula esta propiedad y los factores que influyen en su valor. Comprender la entalpía de vaporización del agua a 100°C nos permitirá comprender mejor los procesos de cambio de fase y su importancia en numerosas aplicaciones tecnológicas. Acompáñanos en este fascinante viaje hacia las entrañas de la termodinámica y descubre cómo el agua se transforma en vapor a temperaturas elevadas.
Cómo calcular la entalpía de vaporización del agua
Entalpía de vaporización del agua a 100°C: ¿Cómo se calcula y qué factores influyen?
La entalpía de vaporización del agua es una propiedad termodinámica que representa la cantidad de energía necesaria para transformar una determinada cantidad de agua líquida en vapor, a una temperatura y presión específicas. En este artículo, explicaremos cómo se calcula esta entalpía y los factores que influyen en su valor, centrándonos en el caso particular de la temperatura de ebullición del agua, es decir, a 100°C.
Para calcular la entalpía de vaporización del agua a 100°C, se utiliza la siguiente fórmula:
ΔHvap = Q / m
Donde ΔHvap es la entalpía de vaporización, Q es la cantidad de calor necesaria para convertir el agua en vapor y m es la masa de agua que se está evaporando.
La cantidad de calor necesaria para convertir una masa determinada de agua en vapor se puede calcular utilizando la ecuación:
Q = m * Hvap
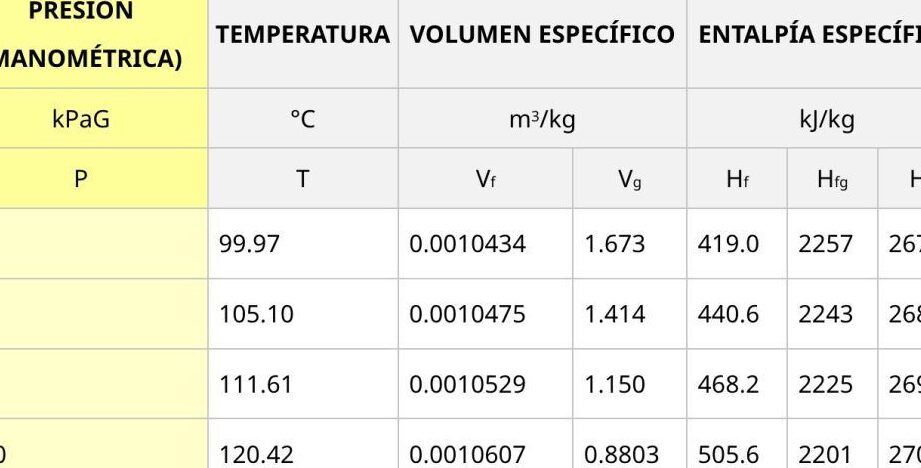
Donde Q es el calor, m es la masa de agua y Hvap es la entalpía de vaporización del agua a 100°C. Para el agua a 100°C, el valor de Hvap es de aproximadamente 40,7 kJ/mol.
Sin embargo, es importante tener en cuenta que la entalpía de vaporización del agua puede variar en función de diferentes factores, como la presión y la temperatura. A medida que la temperatura aumenta, la entalpía de vaporización tiende a disminuir, lo que implica que se necesita menos energía para convertir el agua en vapor. Por otro lado, a medida que la presión aumenta, la entalpía de vaporización tiende a aumentar, ya que se requiere más energía para vencer la presión externa y convertir el agua en vapor.
Además, la entalpía de vaporización también puede depender de la pureza del agua. Impurezas como sales minerales o sustancias disueltas en el agua pueden afectar la entalpía de vaporización, ya que pueden interactuar con las moléculas de agua y dificultar su evaporación.
Cuáles son los factores que afectan la presión de vapor
Entalpía de vaporización del agua a 100°C: ¿Cómo se calcula y qué factores influyen?
La entalpía de vaporización del agua a 100°C es un concepto importante en la termodinámica y tiene diversas aplicaciones en la industria y la ciencia. En este artículo, exploraremos cómo se calcula y qué factores influyen en este proceso.
La entalpía de vaporización es la cantidad de energía necesaria para convertir una sustancia de estado líquido a estado gaseoso a una temperatura y presión constantes. En el caso específico del agua a 100°C, se refiere a la cantidad de energía requerida para convertir el agua líquida en vapor a la temperatura de ebullición.
Para calcular la entalpía de vaporización del agua a 100°C, se utiliza la siguiente fórmula:
ΔH = Q/m
Donde ΔH es la entalpía de vaporización, Q es la cantidad de calor necesaria y m es la masa de agua que se está evaporando.
Existen varios factores que influyen en la entalpía de vaporización del agua a 100°C. A continuación, vamos a analizar algunos de ellos:
1. Presión: La presión externa ejercida sobre el agua afecta la entalpía de vaporización. A una presión más alta, la temperatura de ebullición del agua es mayor, lo que significa que se necesita más energía para convertir el agua en vapor. Por lo tanto, la entalpía de vaporización será mayor a presiones más altas.
2. Temperatura: La temperatura también juega un papel importante en la entalpía de vaporización. A medida que la temperatura aumenta, la energía cinética de las moléculas de agua también aumenta, lo que facilita la transición de estado líquido a gaseoso. Por lo tanto, a temperaturas más altas, se requerirá menos energía para la vaporización y la entalpía de vaporización será menor.
3. Impurezas: La presencia de impurezas en el agua puede afectar su entalpía de vaporización. Las impurezas pueden alterar la estructura molecular del agua y dificultar el proceso de vaporización. Esto significa que se necesitará más energía para vaporizar el agua con impurezas, lo que resultará en una entalpía de vaporización más alta.
Qué es la entalpía del vapor de agua
Entalpía de vaporización del agua a 100°C: ¿Cómo se calcula y qué factores influyen?
La entalpía de vaporización del agua a 100°C es una propiedad termodinámica que describe la cantidad de energía necesaria para convertir una cantidad determinada de agua líquida en vapor a una temperatura constante de 100°C. Esta propiedad es de gran importancia en diversas aplicaciones de ingeniería, como la generación de energía en plantas de energía térmica y la refrigeración en sistemas de aire acondicionado.
La entalpía de vaporización se calcula utilizando la fórmula:
Hvap = Q / m
donde Hvap es la entalpía de vaporización, Q es la cantidad de energía necesaria para convertir el agua en vapor y m es la masa del agua. La cantidad de energía necesaria para la vaporización se puede determinar experimentalmente utilizando calorímetros o mediante cálculos teóricos basados en la ley de conservación de la energía.
La entalpía de vaporización del agua a 100°C puede variar en función de varios factores. Uno de los factores más importantes es la presión a la que se encuentra el agua. A presiones más bajas, la entalpía de vaporización es mayor, lo que significa que se necesita más energía para convertir el agua en vapor. Por el contrario, a presiones más altas, la entalpía de vaporización es menor y se requiere menos energía.
Otro factor que influye en la entalpía de vaporización es la pureza del agua. El agua pura tiene una entalpía de vaporización más alta que el agua que contiene impurezas. Esto se debe a que las impurezas interfieren en el proceso de vaporización, lo que requiere más energía.
Además, la temperatura también puede influir en la entalpía de vaporización. A temperaturas más altas, la entalpía de vaporización es menor, lo que significa que se necesita menos energía para convertir el agua en vapor.
Qué es la evaporación y qué condiciones influyen en su velocidad
Entalpía de vaporización del agua a 100°C: ¿Cómo se calcula y qué factores influyen?
La entalpía de vaporización es una propiedad termodinámica que se refiere a la cantidad de energía necesaria para convertir una sustancia líquida en vapor a una determinada temperatura y presión. En el caso específico del agua a 100°C, la entalpía de vaporización es un valor importante a considerar, ya que representa la cantidad de energía necesaria para convertir el agua líquida en vapor a esa temperatura.
La entalpía de vaporización del agua a 100°C se calcula mediante la fórmula Q = m × ΔHvap, donde Q es la cantidad de energía en julios, m es la masa de agua en gramos y ΔHvap es la entalpía de vaporización en julios por gramo. Esta fórmula nos permite determinar la cantidad de energía necesaria para vaporizar una determinada cantidad de agua a 100°C.
La entalpía de vaporización del agua a 100°C depende de varios factores. Uno de los factores principales es la presión a la que se encuentra el agua. A medida que la presión aumenta, la entalpía de vaporización disminuye, lo que significa que se necesita menos energía para convertir el agua en vapor a una presión más alta. Por otro lado, a presiones más bajas, la entalpía de vaporización aumenta, lo que implica que se necesita más energía para vaporizar el agua.
Otro factor que influye en la entalpía de vaporización del agua a 100°C es la pureza del agua. El agua pura tiene una entalpía de vaporización más alta que el agua con impurezas, ya que las impurezas pueden interferir con las fuerzas intermoleculares y dificultar la vaporización. Por lo tanto, el agua pura requerirá más energía para convertirse en vapor a 100°C que el agua con impurezas.
La temperatura también juega un papel importante en la entalpía de vaporización del agua a 100°C. A temperaturas más altas, la entalpía de vaporización disminuye, lo que significa que se necesita menos energía para vaporizar el agua. Por el contrario, a temperaturas más bajas, la entalpía de vaporización aumenta, lo que implica que se necesita más energía para convertir el agua en vapor.
¡La entalpía de vaporización del agua a 100°C es como el superhéroe del vapor! Se calcula teniendo en cuenta la cantidad de energía que necesita el agua para convertirse en vapor, y factores como la presión y la temperatura influyen en este proceso. Así que ya sabes, si alguna vez necesitas vaporizar agua a 100°C, recuerda que la entalpía está ahí para salvar el día. ¡Vaporízate, agua, vaporízate!












Post Comment