Entalpia del líquido saturado: un concepto clave en termodinámica.
La entalpía del líquido saturado es un concepto fundamental en el estudio de la termodinámica que nos permite comprender en profundidad el comportamiento de las sustancias en diferentes estados. En este artículo, exploraremos en qué consiste este concepto clave y cómo influye en los procesos termodinámicos. ¡Sigue leyendo para descubrir más sobre la entalpía y su importancia en la ciencia de la energía!
El concepto de la entalpía del líquido: una explicación detallada
La entalpía del líquido es una propiedad termodinámica que representa la cantidad de energía en forma de calor absorbida o liberada por un sistema cuando este se encuentra a presión constante. En el caso de un líquido, la entalpía se refiere a la energía total del sistema, que incluye la energía interna, la energía de flujo y la energía de presión-volumen.
La fórmula general para calcular la entalpía del líquido es:
H = U + PV
Donde:
– H es la entalpía del líquido
– U es la energía interna del líquido
– P es la presión
– V es el volumen del líquido
La entalpía del líquido puede variar con la temperatura y la presión. Cuando un líquido absorbe calor a presión constante, su entalpía aumenta, y cuando se libera calor, la entalpía disminuye. Este concepto es fundamental en la termodinámica y se utiliza en numerosos campos científicos y tecnológicos.
El papel fundamental de la entalpía en la termodinámica
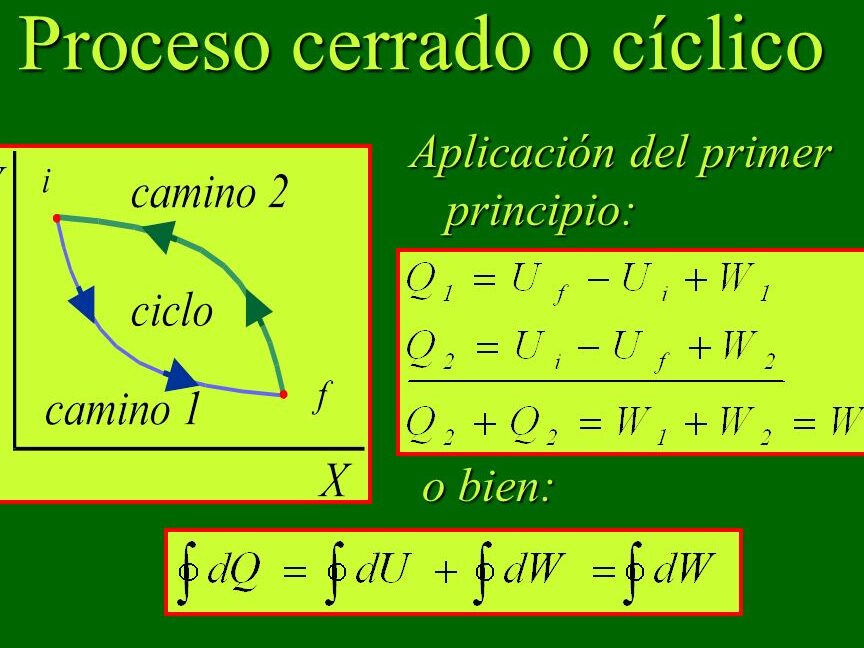
La entalpía es una magnitud termodinámica que se define como la suma de la energía interna de un sistema y del producto de su presión y volumen. En un proceso a presión constante, los cambios en la entalpía del sistema son iguales a la cantidad de calor transferido. En este sentido, la entalpía juega un papel crucial en la termodinámica, ya que nos permite estudiar los intercambios de energía en forma de calor en un sistema bajo condiciones específicas.
Algunos puntos clave sobre el papel de la entalpía en la termodinámica son:
- La entalpía nos permite cuantificar la energía asociada a un sistema termodinámico, considerando tanto su energía interna como la energía requerida para vencer la presión y expandir o comprimir el sistema.
- En reacciones químicas, el cambio en la entalpía (ΔH) nos indica si la reacción es exotérmica (ΔH negativo) o endotérmica (ΔH positivo), lo que resulta crucial para entender si la reacción liberará o absorberá calor.
- La entalpía está relacionada con la ley de la conservación de la energía, permitiéndonos predecir la cantidad de energía intercambiada en forma de calor en un sistema.
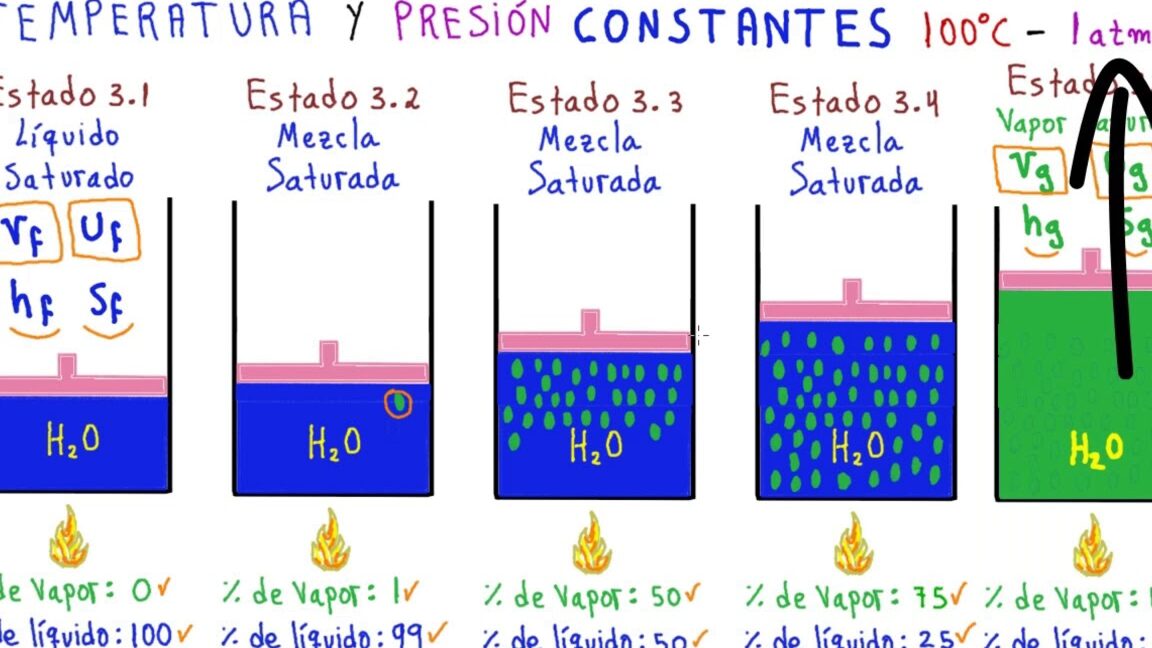
Entendiendo el concepto de líquido saturado en termodinámica
En termodinámica, un **líquido saturado** es aquel que se encuentra en equilibrio con su fase de vapor a una temperatura y presión específicas. En este estado, cualquier adición de calor resultará en la vaporización completa del líquido, manteniendo la presión constante.
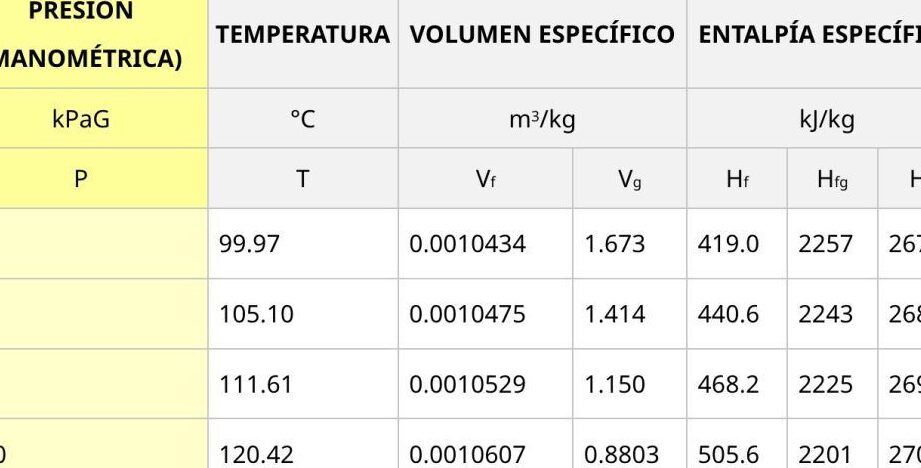
La condición de líquido saturado es crucial en la comprensión de los procesos termodinámicos, ya que representa un punto límite en el que el líquido está a punto de cambiar de fase. En una tabla de propiedades termodinámicas, el líquido saturado se representa con dos columnas: una para el líquido saturado comprimido y otra para el líquido saturado sobrecalentado.
En el caso del líquido saturado comprimido, se encuentra en equilibrio con su vapor a una presión y temperatura específicas, pero en un estado ligeramente más comprimido. Por otro lado, el líquido saturado sobrecalentado se encuentra en equilibrio con su vapor a las mismas condiciones de presión y temperatura, pero en un estado ligeramente más caliente.
Es importante tener en cuenta que el comportamiento de un líquido saturado en un sistema termodinámico puede variar dependiendo de las condiciones de presión y temperatura. Por lo tanto, comprender este concepto es esencial para el análisis preciso de procesos como la evaporación, la condensación y la transferencia de calor en sistemas cerrados.
¡Y hasta aquí llegamos con la entalpía del líquido saturado! Espero que ahora tengas claro que no es solo una palabra rara, ¡sino un concepto clave en termodinámica! Así que ya sabes, la próxima vez que escuches «entalpía del líquido saturado», ¡sonríe y recuerda este post! 😉 ¡Nos vemos en el próximo artículo de Polaridades!











Post Comment