Fórmula del proceso isotérmico: todo lo que necesitas saber
La Fórmula del Proceso Isotérmico es una de las herramientas fundamentales en el estudio de la termodinámica. En este artículo te explicaremos todo lo que necesitas saber sobre esta fórmula, desde su definición hasta su aplicabilidad en diversos campos. Descubrirás cómo el proceso isotérmico es clave para entender los cambios de temperatura y presión en sistemas termodinámicos, y cómo puedes utilizar esta fórmula para resolver problemas prácticos. Si estás interesado en adentrarte en el fascinante mundo de la termodinámica, ¡no puedes perderte esta lectura!
La fórmula del proceso isotérmico: todo lo que necesitas saber
El proceso isotérmico es un concepto fundamental en la termodinámica, que describe un sistema en el cual la temperatura se mantiene constante durante todo el proceso. En este artículo, exploraremos en detalle la fórmula del proceso isotérmico y todo lo que necesitas saber al respecto.
En un proceso isotérmico, la temperatura se mantiene constante, lo que implica que no hay intercambio de calor con el entorno. Esto se logra al mantener el sistema en contacto con un baño térmico que mantiene la temperatura constante.
La fórmula básica del proceso isotérmico es la siguiente:
PV = constante
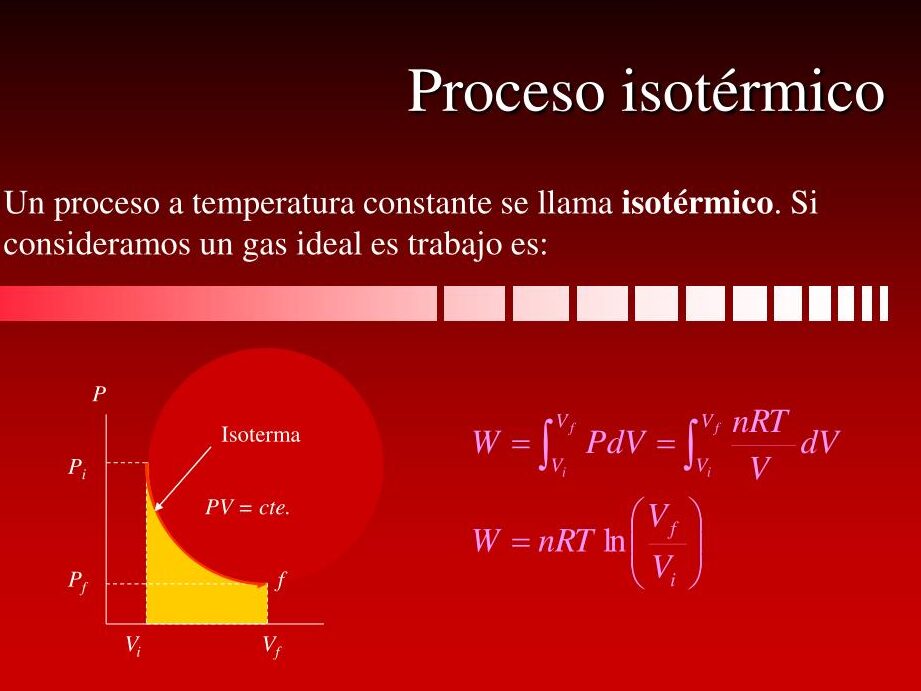
Donde P representa la presión y V el volumen del sistema. Esta fórmula se conoce como la ley de Boyle, en honor al científico Robert Boyle, quien la enunció por primera vez. Según esta ley, si la temperatura se mantiene constante, el producto de la presión y el volumen de un gas también será constante.
Esta fórmula puede ser representada gráficamente en un diagrama PV, donde la curva resultante será una hipérbola. A medida que la presión aumenta, el volumen disminuye y viceversa, manteniendo el producto constante.
Es importante destacar que esta fórmula solo es aplicable en condiciones de temperatura constante. En un proceso isotérmico, la energía interna del sistema se mantiene constante, lo que implica que cualquier cambio en la presión se compensa con un cambio equivalente en el volumen.
Además de la fórmula básica, existen otras ecuaciones y conceptos relacionados con el proceso isotérmico. Algunos de ellos son:
– La ley de Boyle-Mariotte: Esta ley establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Se puede expresar matemáticamente como P1V1 = P2V2, donde P1 y V1 son los valores iniciales de presión y volumen, y P2 y V2 son los valores finales.
– El trabajo en un proceso isotérmico: El trabajo realizado en un proceso isotérmico se puede calcular utilizando la fórmula W = -nRT ln(V2/V1), donde W es el trabajo, n es el número de moles de gas, R es la constante de los gases ideales y T es la temperatura en Kelvin.
Todo lo que necesitas saber sobre el proceso isotérmico y ejemplos prácticos
El proceso isotérmico es un concepto fundamental en la termodinámica que describe una transformación en la cual la temperatura del sistema se mantiene constante. En este artículo, exploraremos en detalle qué es el proceso isotérmico, cómo se representa en un diagrama de presión-volumen y algunos ejemplos prácticos.
En un proceso isotérmico, la temperatura del sistema se mantiene constante en todo momento. Esto implica que la energía interna del sistema no cambia, ya que la temperatura es una medida directa de la energía cinética promedio de las partículas del sistema. Durante este proceso, el sistema intercambia energía con su entorno, pero lo hace de tal manera que la temperatura no varía.
Representación gráfica del proceso isotérmico
Un diagrama de presión-volumen, también conocido como diagrama PV, es una herramienta útil para representar y analizar los procesos termodinámicos. En el caso del proceso isotérmico, la curva que representa esta transformación es una hipérbola equilátera en el diagrama PV.
En un diagrama PV, el eje vertical representa la presión, mientras que el eje horizontal representa el volumen. Durante un proceso isotérmico, la curva que describe la transformación comienza en un punto y se extiende hasta otro punto en el diagrama. Esta curva es simétrica con respecto a la línea que representa la temperatura constante.
Ejemplos prácticos de procesos isotérmicos
1. La expansión de un gas ideal en un cilindro con un pistón móvil: Imagina un cilindro lleno de un gas ideal con un pistón móvil en la parte superior. Si se aplica una fuerza al pistón, se realizará trabajo sobre el gas y este se expandirá. Durante este proceso, la temperatura se mantiene constante, lo que implica que la energía interna del gas no cambia.
2. La compresión de un gas ideal en un compresor: En un compresor, un gas ideal se comprime mediante la aplicación de una fuerza externa. Durante este proceso, la temperatura se mantiene constante, lo que significa que la energía interna del gas no cambia.
3. La evaporación de un líquido: Durante la evaporación de un líquido, la temperatura se mantiene constante.
El comportamiento del calor en un proceso isotérmico
En termodinámica, un proceso isotérmico es aquel en el cual la temperatura se mantiene constante durante todo el proceso. En este tipo de procesos, el comportamiento del calor es de vital importancia y tiene efectos significativos en el sistema estudiado.
Durante un proceso isotérmico, la cantidad de calor transferido hacia o desde el sistema es igual a cero. Esto significa que no se produce un cambio neto en la energía térmica del sistema. Aunque no haya intercambio de calor con el entorno, puede haber trabajo realizado por el sistema o sobre el sistema.
Principios básicos del comportamiento del calor en un proceso isotérmico:
- El calor transferido durante el proceso isotérmico se debe a la diferencia de temperaturas entre el sistema y el entorno, pero como la temperatura se mantiene constante, no hay flujo neto de calor.
- El trabajo realizado durante el proceso isotérmico se debe a la expansión o compresión del sistema. Si el sistema se expande, realiza trabajo sobre el entorno; si se comprime, el entorno realiza trabajo sobre el sistema.
- La ecuación general que describe el comportamiento del calor en un proceso isotérmico es Q = 0, donde Q representa la cantidad de calor transferido.
Aplicaciones y ejemplos de procesos isotérmicos:
- Un ejemplo común de proceso isotérmico es la expansión o compresión de un gas ideal a temperatura constante. Durante este proceso, no hay cambio en la energía térmica del gas, pero se realiza o se recibe trabajo.
- Los motores de combustión interna, como los motores de automóviles, también experimentan procesos isotérmicos en ciertas etapas de su ciclo de funcionamiento. Estos procesos ayudan a mantener la temperatura constante y a optimizar la eficiencia del motor.
¡Y eso es todo, amigos! Ahora que conocéis todos los secretos de la fórmula del proceso isotérmico, ya podéis presumir de ser los más «cool» en cualquier conversación sobre termodinámica. ¡Atrás quedaron los días en los que os preguntabais qué demonios era eso de la isotermia!
Así que ya sabéis, si queréis impresionar a vuestros amigos con vuestros conocimientos científicos, recordad siempre que la fórmula del proceso isotérmico es como ese amigo que siempre mantiene la calma en todas las situaciones. ¡No importa si la presión sube o baja, la temperatura siempre permanecerá constante!
Y ahora, a poner en práctica todo lo aprendido. Si tenéis alguna duda, no dudéis en volver a Polaridades, donde encontraréis más artículos interesantes para saciar vuestra sed de conocimiento. ¡Hasta la próxima, amantes de las fórmulas y los procesos isotérmicos!












Post Comment