La variación periódica de las propiedades atómicas: un recorrido por la tabla periódica
En el fascinante mundo de la química, existe una herramienta fundamental que nos permite comprender la estructura y comportamiento de los elementos: la tabla periódica. Pero, ¿alguna vez te has preguntado por qué los elementos están organizados de esa manera? ¿Qué nos revela esta disposición sobre las propiedades atómicas de cada uno de ellos? En este recorrido por la tabla periódica, descubriremos la sorprendente variación periódica de estas propiedades, desvelando los secretos que se esconden detrás de cada símbolo y número. ¡Prepárate para adentrarte en el apasionante mundo de la química y desvelar los misterios que la tabla periódica guarda para nosotros! Bienvenidos a «La variación periódica de las propiedades atómicas: un recorrido por la tabla periódica».
La variación de las propiedades periódicas: Un análisis detallado de los cambios en la tabla periódica
La tabla periódica de los elementos es una herramienta fundamental en la química, ya que nos permite organizar los elementos de acuerdo a sus propiedades y establecer relaciones entre ellos. Una de las características más interesantes de la tabla periódica es la variación de las propiedades periódicas a medida que se recorre de izquierda a derecha y de arriba a abajo.
La variación de las propiedades periódicas de los elementos a lo largo de un periodo:
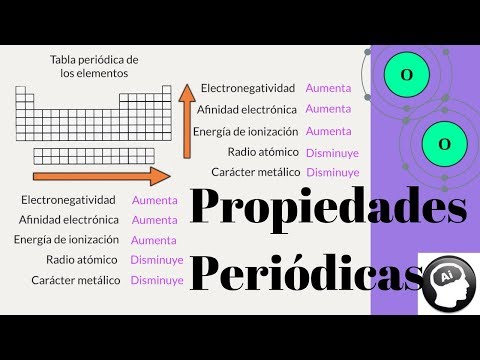
Al recorrer un periodo de la tabla periódica, es decir, una fila horizontal, se pueden observar cambios en las propiedades de los elementos. En general, a medida que se avanza de izquierda a derecha en un periodo, las propiedades de los elementos tienden a cambiar de metálicas a no metálicas.
En los primeros elementos de un periodo, los metales alcalinos y los alcalinotérreos, se encuentran en la parte izquierda de la tabla periódica. Estos elementos son altamente reactivos y tienden a perder electrones para formar iones positivos. A medida que se avanza hacia la parte derecha del periodo, los elementos se vuelven menos metálicos y más no metálicos. Los no metales, como el oxígeno y el flúor, tienen una tendencia a ganar electrones para formar iones negativos.
La variación de las propiedades periódicas de los elementos a lo largo de un grupo:
Al recorrer un grupo de la tabla periódica, es decir, una columna vertical, se pueden observar cambios en las propiedades de los elementos. En general, a medida que se desciende por un grupo, las propiedades de los elementos tienden a cambiar de metálicas a más metálicas.
En la parte superior de un grupo, se encuentran los elementos más pequeños y menos metálicos. A medida que se desciende por el grupo, los elementos se vuelven más grandes y más metálicos. Esto se debe a que a medida que se agregan capas de electrones alrededor del núcleo, el tamaño del átomo aumenta y su capacidad para perder electrones y formar iones positivos también aumenta.
La variación de otras propiedades periódicas:
Además de la variación de las propiedades metálicas y no metálicas a lo largo de un periodo y un grupo, existen otras propiedades periódicas que varían en la tabla periódica. Algunas de estas propiedades incluyen el radio atómico, la energía de ionización, la electronegatividad y la afinidad electrónica.
La evolución de las propiedades en un periodo de la tabla periódica
La tabla periódica de los elementos es una herramienta fundamental en el estudio de la química. Organiza los elementos en función de sus propiedades y nos permite entender las relaciones entre ellos. Una de las características más interesantes de la tabla periódica es la evolución de las propiedades en un periodo.
Un periodo es una fila horizontal en la tabla periódica y representa un nivel de energía. A medida que avanzamos de izquierda a derecha en un periodo, podemos observar una evolución en las propiedades de los elementos.
En primer lugar, podemos notar que el tamaño de los átomos disminuye a medida que avanzamos en un periodo. Esto se debe a que los electrones adicionales se añaden al mismo nivel de energía, pero también a un aumento en la carga nuclear efectiva. Por lo tanto, los electrones están más atraídos hacia el núcleo y el tamaño del átomo se reduce.
Además del tamaño, también podemos observar un cambio en la electronegatividad de los elementos en un periodo. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. En general, la electronegatividad aumenta a medida que avanzamos de izquierda a derecha en un periodo.
Otra propiedad que evoluciona en un periodo es la energía de ionización. La energía de ionización es la cantidad de energía necesaria para arrancar un electrón de un átomo. A medida que avanzamos en un periodo, la energía de ionización aumenta, lo que indica que es más difícil arrancar electrones de los átomos.
También podemos observar cambios en la tendencia de los elementos a perder o ganar electrones en un periodo. En general, los elementos a la izquierda de la tabla periódica tienden a perder electrones y se convierten en cationes positivos, mientras que los elementos a la derecha tienden a ganar electrones y se convierten en aniones negativos.
La evolución de la tabla periódica: Un viaje a través de los elementos químicos
La tabla periódica es una herramienta fundamental en el campo de la química, ya que nos permite organizar y clasificar los elementos químicos de acuerdo a sus propiedades y características. A lo largo de la historia, la tabla periódica ha experimentado diversas evoluciones, en las que se han descubierto nuevos elementos y se ha refinado su organización.
El origen de la tabla periódica se remonta al siglo XIX, cuando los científicos empezaron a darse cuenta de que había una relación entre las propiedades de los elementos y su orden de aparición en la tabla. Uno de los primeros intentos de organizar los elementos fue realizado por Johann Dobereiner, quien en 1829 agrupó a los elementos en tríadas, basándose en sus propiedades químicas similares. Sin embargo, este sistema no fue lo suficientemente completo y preciso.
Fue Dmitri Mendeléyev quien en 1869 propuso la versión más reconocida y aceptada de la tabla periódica. Mendeléyev ordenó los elementos en función de su masa atómica y fue capaz de predecir la existencia de elementos aún no descubiertos. Además, dejó espacios vacíos para aquellos elementos que aún no se habían descubierto, pero que encajaban en la clasificación.
A lo largo del tiempo, se han descubierto nuevos elementos que han sido incluidos en la tabla periódica. Al principio, los elementos se descubrían de forma natural, pero con el avance de la tecnología, los científicos también han sido capaces de sintetizar elementos que no existen de forma natural en la Tierra.
Actualmente, la tabla periódica consta de 118 elementos, organizados en filas horizontales llamadas periodos y columnas verticales llamadas grupos. Cada elemento se representa con un símbolo químico y se le asigna un número atómico y una masa atómica. Además, los elementos están agrupados en bloques de acuerdo a su configuración electrónica.
La tabla periódica no solo es una herramienta importante para los químicos, sino que también tiene aplicaciones en otras disciplinas como la física, la biología y la medicina. Nos permite entender las propiedades y comportamiento de los elementos, así como su reactividad y su capacidad para formar compuestos.
¡Y así llegamos al final de nuestro viaje por la maravillosa tabla periódica! ¿Quién diría que los elementos químicos podían ser tan entretenidos, verdad? Ahora que sabemos cómo varían periódicamente las propiedades atómicas, podemos impresionar a nuestros amigos en la próxima fiesta con datos curiosos sobre el carbono o el helio. ¡Seremos los reyes de la química!
Pero recuerda, no intentes hacer experimentos en casa sin supervisión de un experto. No queremos convertirnos en el Dr. Jekyll y Mr. Hyde por mezclar elementos de manera irresponsable. Aunque, ¿quién sabe? Tal vez descubras la fórmula del elixir de la juventud o el secreto para convertir plomo en oro. ¡Si lo logras, no dudes en compartirlo con nosotros!
Y así concluye nuestro paseo por la tabla periódica. Espero que hayas disfrutado tanto como yo de este recorrido lleno de elementos fascinantes y propiedades sorprendentes. No olvides seguir explorando el maravilloso mundo de la química, porque siempre hay algo nuevo por descubrir. ¡Hasta la próxima, amantes de la ciencia!













Post Comment