Relación entre la presión y la temperatura: La clave está en la tabla
Descubre en este artículo la fascinante relación entre la presión y la temperatura, y cómo una simple tabla puede revelar secretos asombrosos. ¡No te pierdas esta reveladora información en Polaridades!
La influencia de la temperatura en la presión: una relación clave
La relación entre la temperatura y la presión es un fenómeno fundamental en diversos campos científicos y tecnológicos. A medida que la temperatura aumenta, la presión tiende a incrementarse, y viceversa. Este principio se puede explicar a través de la ley de Charles y la ley de Boyle, que establecen que, a temperatura constante, la presión de un gas es inversamente proporcional a su volumen, y que, a volumen constante, la presión es directamente proporcional a la temperatura.
- **Ley de Charles**: Establece que, a presión constante, el volumen de una cantidad fija de gas es directamente proporcional a su temperatura en grados Kelvin.
- **Ley de Boyle**: Establece que, a temperatura constante, el volumen de una cantidad fija de gas es inversamente proporcional a la presión.
Esta relación es de suma importancia en áreas como la meteorología, la física y la química. En meteorología, por ejemplo, la presión atmosférica disminuye con la altura debido al cambio de temperatura, lo que influye en la formación de fenómenos atmosféricos como los vientos y las tormentas.
La relación entre volumen, presión y temperatura: una explicación detallada
La relación entre el volumen, la presión y la temperatura de un gas está descrita por la Ley de los Gases Ideales, también conocida como la Ley de Boyle-Mariotte, la Ley de Charles y la Ley de Gay-Lussac. Estas leyes establecen cómo cambian estas magnitudes en un gas ideal en diferentes condiciones.
Ley de Boyle-Mariotte: Esta ley establece que, a temperatura constante, el volumen de una cantidad fija de gas es inversamente proporcional a la presión a la que está sometido. Es decir, si la presión aumenta, el volumen disminuye y viceversa.
Ley de Charles: Según esta ley, a presión constante, el volumen de una cantidad fija de gas es directamente proporcional a su temperatura en grados Celsius. Si la temperatura aumenta, el volumen también lo hace.
Ley de Gay-Lussac: Esta ley indica que, a volumen constante, la presión de una cantidad fija de gas es directamente proporcional a su temperatura en grados Celsius. Si la temperatura aumenta, la presión del gas también lo hace.
La Ley Combinada de los Gases: La combinación de las tres leyes anteriores da lugar a la Ley General de los Gases, que relaciona el volumen, la presión y la temperatura de un gas de manera general.
Entendiendo la ley de Boyle: relación entre presión y volumen en los gases
La ley de Boyle establece que, manteniendo constante la temperatura, la presión y el volumen de una cierta cantidad de gas son inversamente proporcionales. Es decir, si la presión aumenta, el volumen disminuirá, y viceversa. Esta ley fue enunciada por el científico Robert Boyle en el siglo XVII y es fundamental en el estudio de la física de los gases.
En términos matemáticos, la ley de Boyle se expresa de la siguiente manera:
P1 * V1 = P2 * V2
Donde:
– P1 y V1 representan la presión y el volumen iniciales del gas.
– P2 y V2 representan la presión y el volumen finales del gas.
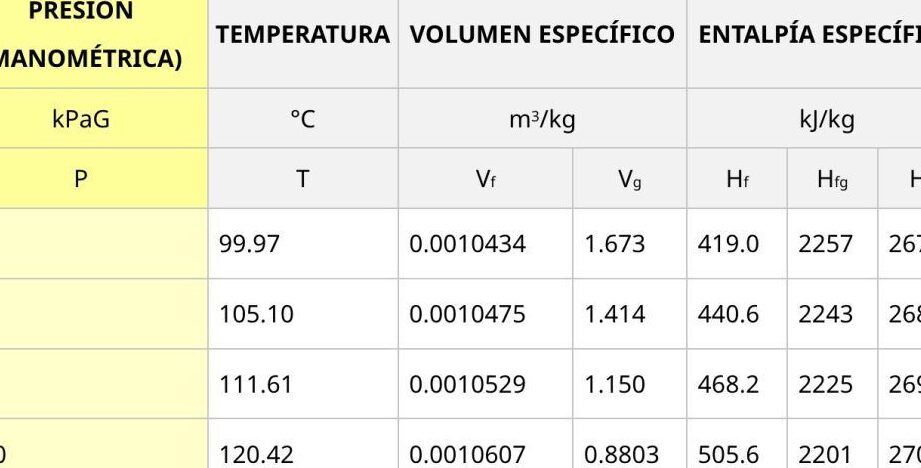
Esta relación se puede visualizar mejor a través de una tabla, donde se muestra cómo varían la presión y el volumen de un gas de manera inversamente proporcional:
| Presión (P) | Volumen (V) |
|---|---|
| P1 | V1 |
| P2 | V2 |
¡Y así es como la presión y la temperatura se dieron cuenta de que estaban hechas el uno para el otro! Ahora solo les falta ponerse de acuerdo en si suben o bajan juntas. ¡Qué lío tienen montado estas dos! Pero tranquilo, en Polaridades te seguiremos desvelando los secretos de esta relación tan intensa. ¡Hasta la próxima, amantes de la física!












Post Comment