Entendiendo el concepto de la regla de Hund en la electrónica
Introducción:
La electrónica es un mundo fascinante que nos rodea en nuestro día a día. Desde los dispositivos más simples hasta los más complejos, todos ellos se rigen por una serie de principios y reglas que determinan su funcionamiento. Uno de estos conceptos es la regla de Hund, un principio fundamental en la electrónica que nos ayuda a entender cómo se organizan los electrones en los átomos y las moléculas. En este artículo, exploraremos en detalle este concepto y su importancia en el fascinante mundo de la electrónica. ¡Acompáñanos en este viaje de descubrimiento y aprendizaje!
Que explica la regla de Pauli y Hund
Entendiendo el concepto de la regla de Hund en la electrónica
La regla de Hund es un principio fundamental en la mecánica cuántica que describe cómo se llenan los orbitales en un átomo. Esta regla fue formulada por Friedrich Hund y establece que, cuando se llenan los orbitales de un subnivel, los electrones tienden a ocupar primero los orbitales con sus espines paralelos antes de emparejarse.
La regla de Pauli es otro principio importante en la mecánica cuántica que establece que no puede haber dos electrones en un átomo que tengan los mismos cuatro números cuánticos. Estos números cuánticos son el número cuántico principal, el número cuántico secundario, el número cuántico magnético y el número cuántico de espín.
Para entender mejor la regla de Hund, es importante comprender primero cómo se organizan los electrones en los orbitales. Los orbitales pueden acomodar un máximo de dos electrones, y estos electrones deben tener espines opuestos (uno hacia arriba y otro hacia abajo). Los orbitales se llenan en un orden específico siguiendo la regla de Aufbau, que establece que los electrones se colocan en los orbitales de menor energía primero.
La regla de Hund viene a jugar cuando hay varios orbitales de igual energía disponibles. En estos casos, los electrones tienden a ocupar los orbitales con sus espines paralelos antes de emparejarse. Esto se debe a que los electrones con espines paralelos tienen energías más bajas y, por lo tanto, el sistema es más estable.
Por ejemplo, consideremos el subnivel p, que tiene tres orbitales (px, py y pz). Según la regla de Hund, los electrones ocuparán inicialmente un solo orbital con sus espines paralelos antes de emparejarse. Esto se debe a que, al ocupar inicialmente un solo orbital con espines paralelos, se minimiza la repulsión electrónica y se maximiza la estabilidad del sistema.
Es importante destacar que la regla de Hund se aplica cuando hay orbitales de igual energía disponibles. Si hay orbitales de diferentes energías, se seguirá la regla de Aufbau y se llenarán primero los orbitales de menor energía.
Qué significa que la construcción de la estructura electrónica debe hacerse siguiendo la regla de Hund
Entendiendo el concepto de la regla de Hund en la electrónica
La construcción de la estructura electrónica de un átomo es fundamental para comprender su comportamiento químico y sus propiedades físicas. Una regla importante en este proceso es la regla de Hund, que establece cómo se llenan los orbitales en un átomo.
La regla de Hund establece que, al llenar los orbitales de energía igual, cada orbital debe contener un electrón con espín paralelo antes de que se emparejen los electrones en los orbitales. En otras palabras, los electrones tienden a ocupar orbitales vacíos de la misma energía antes de que comiencen a emparejarse.
Esta regla se basa en el principio de exclusión de Pauli, que establece que dos electrones en un átomo no pueden tener los mismos cuatro números cuánticos. Los números cuánticos son valores que describen las propiedades de los electrones, como su energía y posición.
La regla de Hund es especialmente relevante cuando se considera la configuración electrónica de los elementos de transición y los elementos de la última fila de la tabla periódica. Estos elementos tienen orbitales d y f, que tienen mayor capacidad para albergar electrones. La regla de Hund asegura que estos orbitales se llenen de manera adecuada antes de que se emparejen los electrones.
La importancia de seguir la regla de Hund radica en que afecta directamente las propiedades químicas y físicas de los elementos. Al llenar los orbitales de energía igual de manera adecuada, se asegura que los electrones estén lo más separados posible, minimizando así las repulsiones electrón-electrón y optimizando la estabilidad del átomo.
Quién fue el que plantea la regla de Hund
Entendiendo el concepto de la regla de Hund en la electrónica
La regla de Hund, también conocida como la regla de máxima multiplicidad, es una regla en la física cuántica que se utiliza para determinar la configuración electrónica de los átomos. Fue propuesta por Friedrich Hund, un físico alemán, en el año 1927.
Esta regla establece que, cuando se llenan los orbitales de una capa electrónica, los electrones tienden a ocupar primero los orbitales individuales con su espín paralelo antes de emparejarse en el mismo orbital. En otras palabras, los electrones prefieren ocupar orbitales vacíos antes de compartir el mismo orbital con otro electrón.
Esta regla es importante en la comprensión de la estructura electrónica de los átomos, ya que nos permite predecir cómo se distribuyen los electrones en los diferentes niveles y subniveles de energía. Además, la regla de Hund también tiene implicaciones en la forma en que los átomos se enlazan entre sí para formar moléculas.
Para entender mejor esta regla, consideremos el caso del átomo de carbono. El carbono tiene una configuración electrónica de 1s2 2s2 2p2. Según la regla de Hund, los electrones llenan primero los orbitales 2s y 2p con su espín paralelo antes de emparejarse. Esto significa que en lugar de tener dos electrones en el mismo orbital 2p, tendremos un electrón en cada uno de los tres orbitales 2p, todos con su espín paralelo.
La regla de Hund también se aplica a los elementos de transición y a los iones. Por ejemplo, el ion de manganeso (Mn2+) tiene una configuración electrónica de [Ar] 3d5. Siguiendo la regla de Hund, los cinco electrones en los orbitales 3d se distribuyen de manera que todos tengan su espín paralelo antes de emparejarse.
¡Así que ahí lo tienes! Ahora eres un experto en la regla de Hund. No te preocupes, ¡no tienes que ladrar como un perro para entenderla! Pero recuerda, si estás buscando una forma divertida de recordar cómo se llenan los electrones en los orbitales, solo piensa en un perrito juguetón que quiere su propio espacio en el parque. ¡Woof woof!
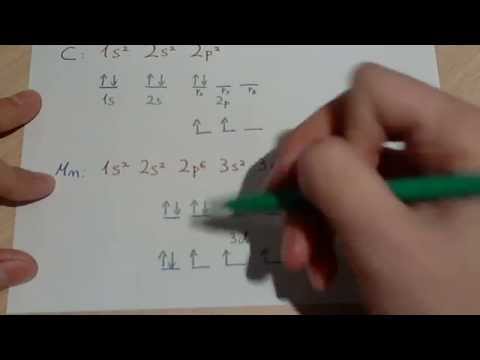












Post Comment