El agua como soluto: una perspectiva química
El agua, ese elemento tan fundamental y omnipresente en nuestras vidas, desempeña un papel crucial como soluto en numerosos procesos químicos. En este artículo, exploraremos desde una perspectiva química la fascinante interacción del agua como soluto en diversas soluciones, revelando sus sorprendentes propiedades y su impacto en nuestro entorno. Sumérgete en el mundo de las soluciones acuosas y descubre la magia detrás de este líquido vital. ¡Acompáñanos en este viaje de descubrimiento!
El poder del agua como soluto: un recurso versátil y fundamental
| El poder del agua como soluto: un recurso versátil y fundamental |
El agua es un solvente universal que desempeña un papel crucial en numerosos procesos biológicos, químicos e industriales. Su capacidad para disolver una amplia variedad de sustancias la convierte en un recurso versátil y fundamental en diferentes ámbitos:
- En la biología: El agua es el medio en el que tienen lugar la mayoría de las reacciones bioquímicas en los organismos vivos. Actúa como solvente para transportar nutrientes y desechos a través de las células.
- En la química: El agua es un solvente polar que puede disolver sales, azúcares, ácidos y muchas otras sustancias. Su polaridad le permite formar puentes de hidrógeno con otras moléculas, lo que facilita las reacciones químicas.
- En la industria: El agua se utiliza como disolvente en numerosos procesos industriales, como la fabricación de productos químicos, la limpieza de equipos, la disolución de sustancias para la producción de alimentos, entre otros.
La capacidad del agua para disolver sustancias se debe a su estructura molecular única, que le otorga propiedades especiales. Su polaridad y capacidad para formar puentes de hidrógeno la convierten en un solvente eficaz en una amplia gama de aplicaciones.
El agua: Un análisis desde la química
El agua es una sustancia esencial para la vida en la Tierra. Desde el punto de vista de la química, el agua es conocida como H2O, lo que significa que una molécula de agua está compuesta por dos átomos de hidrógeno y uno de oxígeno. Esta combinación le otorga propiedades únicas que la hacen crucial para los procesos biológicos y químicos.
Algunos aspectos clave a considerar sobre el agua desde la perspectiva de la química son:
- Estructura molecular: La molécula de agua tiene una forma angular debido a la disposición de los átomos de hidrógeno y oxígeno. Esta estructura es fundamental para entender muchas de las propiedades físicas y químicas del agua.
- Polaridad: El agua es una molécula polar, lo que significa que tiene una distribución desigual de carga eléctrica. El oxígeno tiene una carga parcial negativa, mientras que los hidrógenos tienen carga parcial positiva. Esta polaridad es responsable de muchas de las propiedades del agua, como su capacidad para disolver sustancias.
- Puentes de hidrógeno: Debido a la polaridad del agua, las moléculas de agua pueden formar puentes de hidrógeno entre sí. Estos enlaces son débiles pero fundamentales para muchas de las propiedades únicas del agua, como su alta tensión superficial y su capacidad para moderar la temperatura.
- Capacidad calorífica: El agua tiene una alta capacidad calorífica, lo que significa que puede absorber y retener grandes cantidades de calor con cambios mínimos en su temperatura. Esta propiedad es esencial para regular la temperatura corporal y climática en la Tierra.
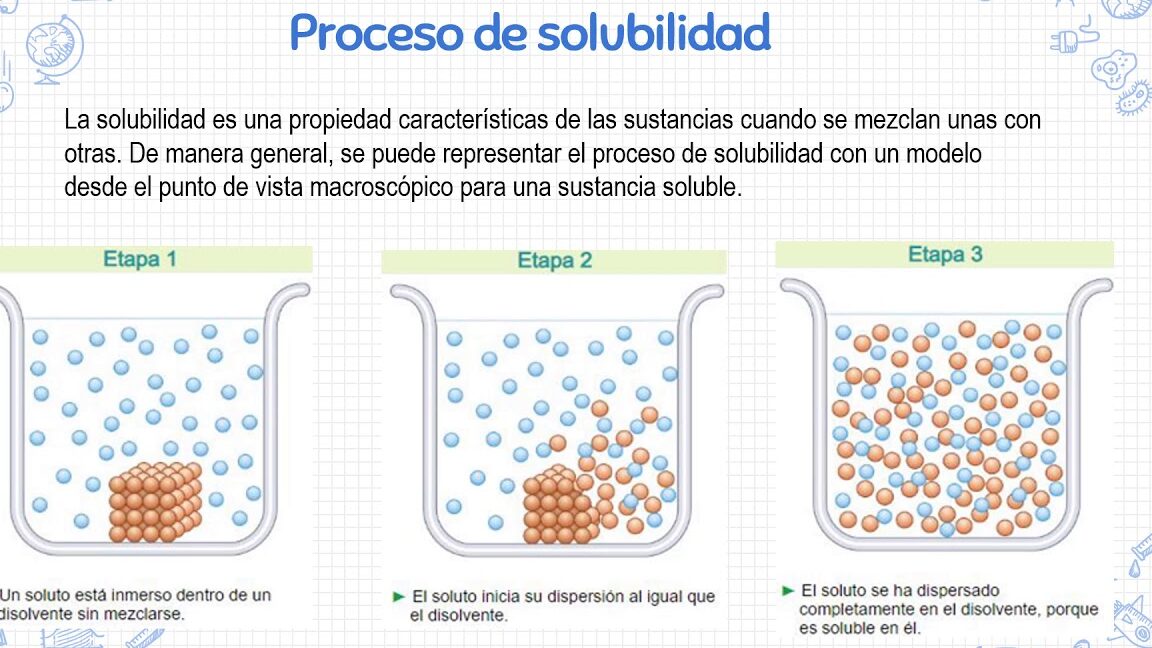
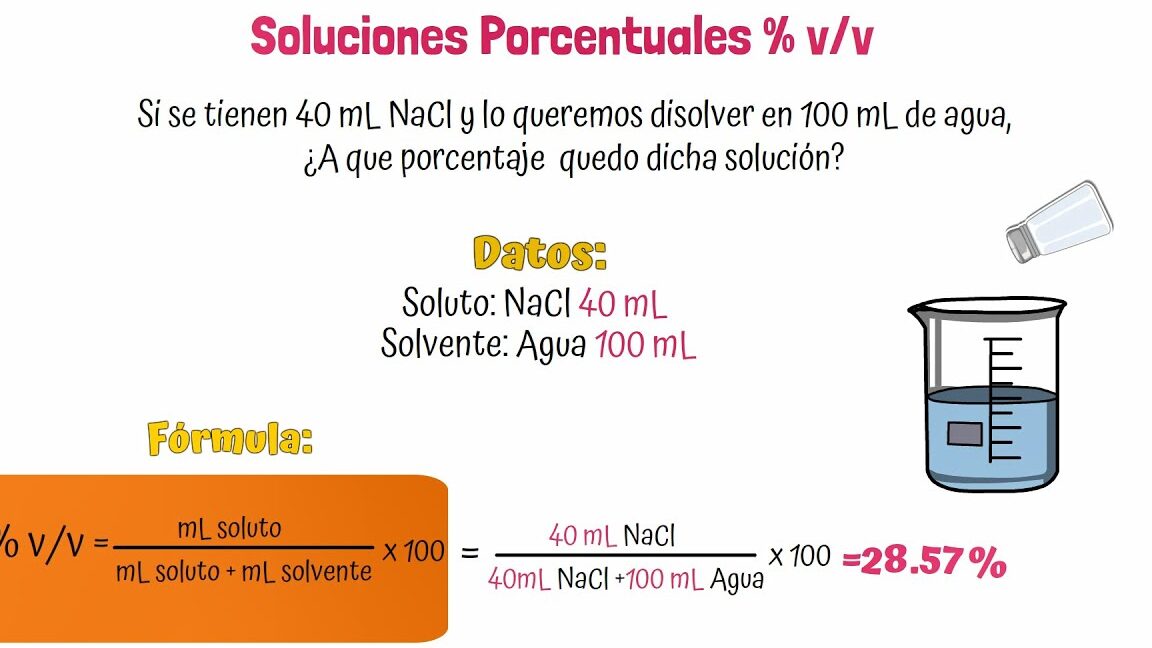
- Disolvente universal: El agua es conocida como el disolvente universal debido a su capacidad para disolver una amplia variedad de sustancias. Esta propiedad es fundamental para los procesos biológicos y químicos en los organismos vivos.
El papel fundamental del agua como solvente en las reacciones químicas
El agua es un solvente esencial en las reacciones químicas debido a su naturaleza polar. Como solvente universal, el agua tiene la capacidad de disolver una amplia variedad de sustancias, lo que la convierte en un componente crucial en la química y en la vida misma.
- La polaridad del agua se debe a la distribución desigual de cargas en la molécula, con el oxígeno siendo parcialmente negativo y los hidrógenos parcialmente positivos. Esto permite que el agua interactúe con compuestos iónicos y polares, disolviéndolos en sus componentes más básicos.
- En las reacciones químicas, el agua actúa como un medio donde ocurren las interacciones entre los reactivos, facilitando la ruptura y formación de enlaces químicos. Al disolver los reactivos, el agua ayuda a que las moléculas se dispersen y colisionen, aumentando la probabilidad de que reaccionen entre sí.
- El agua también es crucial en la hidrólisis, un proceso en el cual una molécula se divide en dos partes al añadir una molécula de agua. Este mecanismo es fundamental en la digestión de alimentos y en la síntesis de moléculas biológicas.
- Además, en las reacciones enzimáticas, el agua sirve como medio donde se llevan a cabo las interacciones entre la enzima y su sustrato, facilitando la catálisis de las reacciones bioquímicas.
¡Y así es como el agua, ese líquido tan molón, se convierte en el rey de los solutos! ¿Quién diría que algo tan simple como H2O sería el protagonista de esta historia química? ¡Brindemos por el agua y sus increíbles habilidades para disolverse en cualquier fiesta química! ¡Hasta la próxima, químicos y químicas!













Post Comment