El cloro y su influencia en la electronegatividad
El cloro, un elemento químico esencial en nuestro día a día, desempeña un papel crucial en la electronegatividad de las sustancias. Descubre en este artículo cómo su presencia impacta en las propiedades de los compuestos químicos y cómo influye en la polaridad molecular. ¡Sumérgete en el fascinante mundo del cloro y su influencia en la electronegatividad!
Factores que determinan la electronegatividad
Factores que determinan la electronegatividad
La electronegatividad es una propiedad química que mide la capacidad de un átomo de atraer hacia sí los electrones compartidos en un enlace químico. Varios factores influyen en la electronegatividad de un átomo. Algunos de los más relevantes son:
- Tamaño del átomo: En general, a mayor tamaño de un átomo, menor es su electronegatividad. Esto se debe a que los electrones están más alejados del núcleo y la fuerza de atracción es menor.
- Carga nuclear efectiva: Cuanto mayor sea la carga nuclear efectiva de un átomo, mayor será su electronegatividad. La carga nuclear efectiva se refiere a la fuerza con la que el núcleo atrae a los electrones de la capa de valencia.
- Número de oxidación: Los átomos con mayor número de oxidación tienden a ser más electronegativos, ya que necesitan aceptar electrones para completar su capa de valencia.
- Electrones de valencia: Los átomos con una mayor cantidad de electrones en su capa de valencia tienden a ser más electronegativos, ya que tienen una mayor capacidad para atraer electrones adicionales.
El carácter electronegativo del cloro: todo lo que necesitas saber
El carácter electronegativo del cloro: todo lo que necesitas saber
El carácter electronegativo del cloro es una propiedad química fundamental que juega un papel crucial en diversas reacciones y en la formación de compuestos. Aquí te presentamos todo lo que necesitas saber al respecto:
- ¿Qué es la electronegatividad?: La electronegatividad es la capacidad de un átomo de atraer hacia sí los electrones en un enlace químico. Cuanto mayor sea la electronegatividad de un átomo, mayor será su atracción por los electrones.
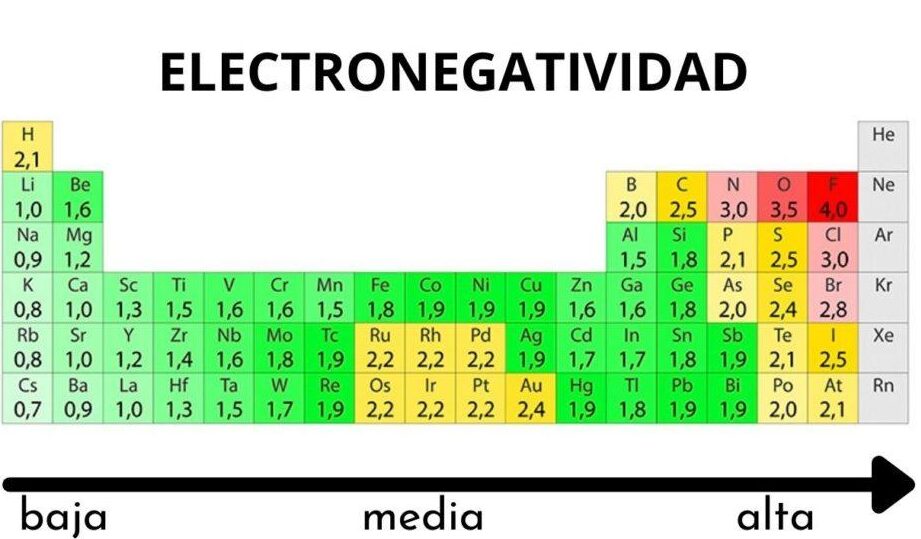
- Carácter electronegativo del cloro: El cloro es uno de los elementos más electronegativos de la tabla periódica. Su electronegatividad es de 3.16 en la escala de Pauling, lo que lo convierte en un átomo altamente atractivo para los electrones en un enlace químico.
- Implicaciones en la formación de compuestos: Debido a su alto carácter electronegativo, el cloro tiende a formar enlaces fuertes con otros elementos menos electronegativos. Esto se observa en compuestos como el cloruro de sodio (NaCl) y en los diversos clorofluorocarbonos utilizados en la industria.
- Interacción en moléculas orgánicas: En moléculas orgánicas, el cloro puede actuar como un grupo funcional, participando en reacciones químicas específicas y afectando las propiedades de la molécula en la que se encuentra.
- Comparativa con otros elementos: A la hora de comparar el carácter electronegativo del cloro con otros elementos, se encuentra por encima de elementos como el carbono, el hidrógeno y el oxígeno, lo que influye en la polaridad de los enlaces que forma.
El incremento de la electronegatividad: factores y consecuencias
La electronegatividad es una propiedad química que mide la capacidad de un átomo de atraer electrones hacia sí mismo cuando forma un enlace químico. Se incrementa a medida que nos desplazamos hacia la derecha en un periodo de la tabla periódica y hacia arriba en un grupo.
El aumento de la electronegatividad se debe a varios factores, entre los que destacan el tamaño del átomo y la carga nuclear efectiva. A medida que un átomo es más pequeño, los electrones están más cerca del núcleo, lo que aumenta su capacidad de atracción. Asimismo, a mayor carga nuclear efectiva, mayor será la electronegatividad.
Consecuencias del incremento de la electronegatividad:
- Mayor polaridad en los enlaces químicos: Cuando dos átomos con electronegatividades diferentes se unen, se forma un enlace polar donde uno atrae más los electrones que el otro.
- Mayor capacidad de un átomo para atraer electrones: Los átomos con alta electronegatividad tienden a ganar electrones en una reacción química.
- Mayor acidez de los compuestos: Los ácidos tienden a tener átomos con alta electronegatividad, ya que atraen los electrones de los enlaces de hidrógeno con mayor fuerza.
¡Es hora de poner fin a este viaje por el mundo del cloro y su influencia en la electronegatividad! Esperemos que hayas disfrutado tanto como un átomo de cloro compartiendo electrones. ¡Nos vemos en el próximo artículo, donde exploraremos nuevas polaridades que te dejarán electrificado!













Post Comment