Masa molar del ácido acético: ¿Cómo calcularla y por qué es importante?
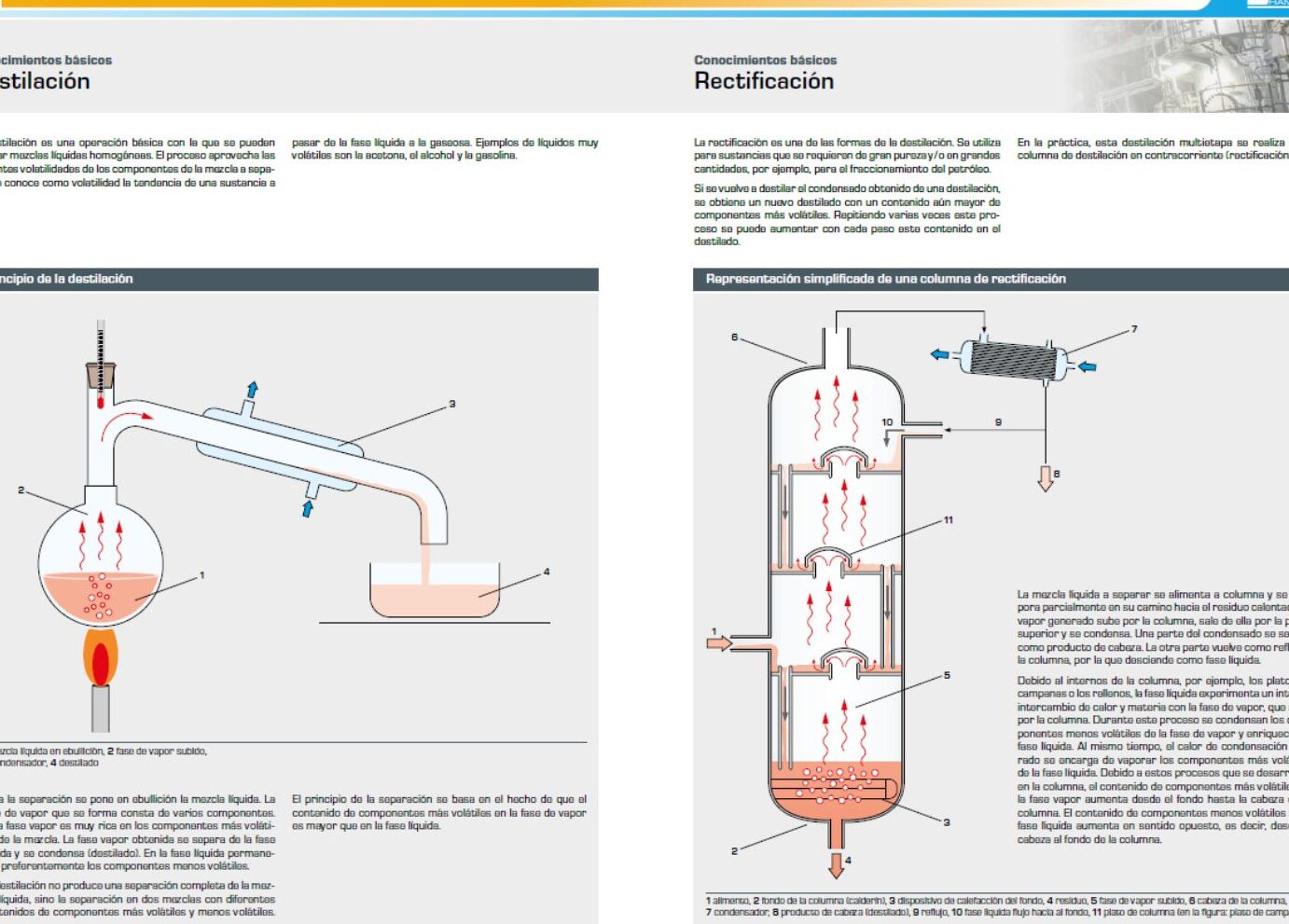
La masa molar del ácido acético es un concepto fundamental en la química y tiene una gran importancia en diversos campos, desde la farmacia hasta la industria alimentaria. En este artículo, exploraremos cómo calcular la masa molar del ácido acético y entenderemos por qué este cálculo es tan crucial. Acompáñanos en este fascinante viaje al mundo de la química y descubre cómo la masa molar del ácido acético puede influir en nuestras vidas de formas sorprendentes. ¡Comencemos!
Cómo calcular la masa molar de ácido acético
Masa molar del ácido acético: ¿Cómo calcularla y por qué es importante?
El ácido acético, también conocido como ácido etanoico, es un compuesto químico ampliamente utilizado en diversas industrias, desde la producción de alimentos hasta la fabricación de productos farmacéuticos. Calcular la masa molar del ácido acético es fundamental para comprender su comportamiento químico y realizar cálculos precisos en el laboratorio. En este artículo, exploraremos cómo calcular la masa molar del ácido acético y por qué es importante.
¿Qué es la masa molar?
La masa molar es la masa de una sustancia expresada en gramos por mol. Se utiliza para determinar la cantidad de sustancia presente en una muestra y se expresa en la unidad de medida llamada «mol». La masa molar se calcula sumando las masas atómicas de todos los átomos en la fórmula química de una sustancia.
Cálculo de la masa molar del ácido acético
La fórmula química del ácido acético es CH3COOH. Para calcular la masa molar, debemos conocer las masas atómicas de los elementos que lo componen. En este caso, el carbono (C) tiene una masa atómica de 12.01 g/mol, el hidrógeno (H) tiene una masa atómica de 1.01 g/mol y el oxígeno (O) tiene una masa atómica de 16.00 g/mol.
Podemos calcular la masa molar del ácido acético sumando las masas atómicas de cada elemento multiplicadas por su respectiva cantidad en la fórmula química. En este caso, tenemos un átomo de carbono, dos átomos de hidrógeno y dos átomos de oxígeno.
Masa molar del ácido acético = (masa atómica del carbono × cantidad de carbono) + (masa atómica del hidrógeno × cantidad de hidrógeno) + (masa atómica del oxígeno × cantidad de oxígeno)
Masa molar del ácido acético = (12.01 g/mol × 1) + (1.01 g/mol × 3) + (16.00 g/mol × 2)
Masa molar del ácido acético = 12.01 g/mol + 3.03 g/mol + 32.00 g/mol
Masa molar del ácido acético = 47. /mol
Por lo tanto, la masa molar del ácido acético es de 47.
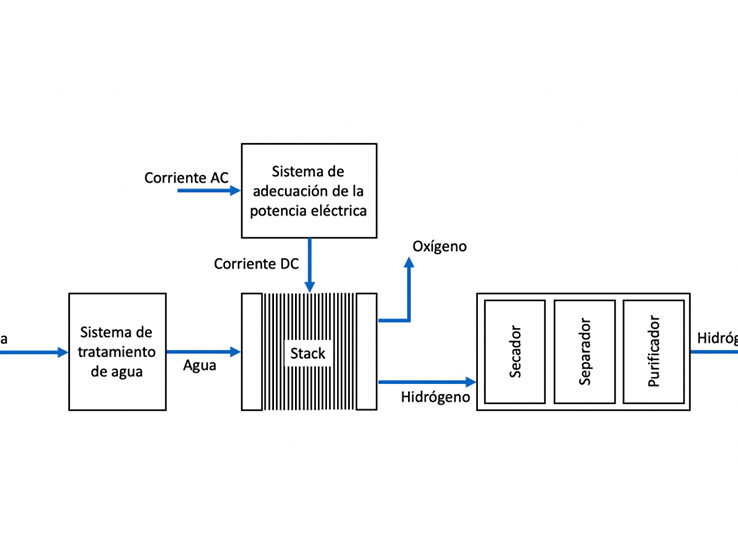
Cuál es la importancia del ácido acético
Masa molar del ácido acético: ¿Cómo calcularla y por qué es importante?
El ácido acético, también conocido como ácido etanoico, es un compuesto químico orgánico que juega un papel fundamental en una amplia variedad de aplicaciones industriales y domésticas. En este artículo, exploraremos la importancia de conocer la masa molar del ácido acético, cómo calcularla y por qué es relevante en diferentes contextos.
La masa molar se refiere a la masa de una sustancia en una unidad de masa específica, generalmente gramos por mol. En el caso del ácido acético, su fórmula química es CH3COOH. Para calcular la masa molar, debemos sumar las masas atómicas de cada uno de los átomos presentes en la fórmula química.
La masa molar del ácido acético se calcula sumando las masas atómicas de cada elemento: carbono (C), hidrógeno (H) y oxígeno (O). El carbono tiene una masa atómica de aproximadamente 12.01 gramos por mol, el hidrógeno tiene una masa atómica de aproximadamente 1.01 gramos por mol y el oxígeno tiene una masa atómica de aproximadamente 16 gramos por mol.
La fórmula química del ácido acético es:
- 1 átomo de carbono
- 2 átomos de hidrógeno
- 2 átomos de oxígeno
Calculando la masa molar del ácido acético:
(1 x masa atómica del carbono) + (2 x masa atómica del hidrógeno) + (2 x masa atómica del oxígeno) = masa molar del ácido acético
(1 x 12.01) + (2 x 1.01) + (2 x 16) = 60.05 gramos por mol
Conocer la masa molar del ácido acético es importante por varias razones. En primer lugar, es esencial para realizar cálculos precisos en diversas aplicaciones científicas y químicas. Por ejemplo, al trabajar en un laboratorio, es necesario conocer la masa molar para calcular la cantidad exacta de ácido acético que se necesita en una reacción química.
Además, la masa molar del ácido acético es relevante en la industria alimentaria. El ácido acético se utiliza en la producción de vinagre, que es ampliamente utilizado como condimento y conservante en alimentos.
Qué es la masa molar y cómo se calcula
Masa molar del ácido acético: ¿Cómo calcularla y por qué es importante?
El ácido acético es una sustancia química comúnmente utilizada en la industria y en el hogar. Es conocido por su olor característico y se encuentra en muchos productos, como vinagre y alimentos fermentados. Para comprender mejor esta sustancia, es importante entender qué es la masa molar y cómo se calcula.
La masa molar es la masa de una sustancia expresada en gramos por mol. Se utiliza para determinar la cantidad de sustancia presente en una muestra, así como para realizar cálculos estequiométricos. La masa molar se calcula sumando las masas atómicas de los elementos presentes en la fórmula química de la sustancia.
En el caso del ácido acético, su fórmula química es CH3COOH. Para calcular la masa molar del ácido acético, se deben sumar las masas atómicas de los átomos de carbono (C), hidrógeno (H) y oxígeno (O) presentes en la fórmula.
La masa atómica del carbono es de aproximadamente 12.01 g/mol, la masa atómica del hidrógeno es de aproximadamente 1.01 g/mol y la masa atómica del oxígeno es de aproximadamente 16.00 g/mol. Por lo tanto, la masa molar del ácido acético se puede calcular de la siguiente manera:
(12.01 g/mol × 2) + (1.01 g/mol × 4) + (16.00 g/mol × 2) = 60.05 g/mol
La masa molar del ácido acético es de aproximadamente 60.05 g/mol. Esto significa que en cada mol de ácido acético, hay aproximadamente 60.05 gramos de sustancia.
La masa molar del ácido acético es importante por varias razones. En primer lugar, se utiliza para determinar la cantidad de ácido acético presente en una muestra. Esto es especialmente útil en aplicaciones industriales donde se necesita controlar la concentración de ácido acético en un producto.
Además, la masa molar del ácido acético es necesaria para realizar cálculos estequiométricos. Estos cálculos son importantes para determinar las cantidades exactas de reactivos necesarios para una reacción química, así como para predecir los productos de una reacción.
Qué utilidad tiene conocer la masa molar de una sustancia
Masa molar del ácido acético: ¿Cómo calcularla y por qué es importante?
El ácido acético, también conocido como ácido etanoico, es una sustancia química comúnmente utilizada en la industria y en el hogar. Conocer su masa molar es fundamental para comprender su comportamiento y aplicaciones en diferentes contextos. En este artículo, exploraremos cómo calcular la masa molar del ácido acético y por qué es importante.
¿Qué es la masa molar?
La masa molar de una sustancia se refiere a la masa de un mol de esa sustancia, expresada en gramos por mol (g/mol). Un mol es una unidad de medida que representa una cantidad específica de partículas, ya sea átomos, moléculas o iones. Por lo tanto, la masa molar nos permite conocer cuántos gramos de una sustancia hay en un mol.
Cálculo de la masa molar del ácido acético
El ácido acético tiene una fórmula química de CH3COOH. Para calcular su masa molar, necesitamos conocer las masas atómicas de cada elemento presente en la fórmula y multiplicarlas por el número de átomos correspondiente.
- Carbono (C): masa atómica de 12.01 g/mol
- Hidrógeno (H): masa atómica de 1.01 g/mol
- Oxígeno (O): masa atómica de 16.00 g/mol
En la fórmula del ácido acético, hay 2 átomos de carbono, 4 átomos de hidrógeno y 2 átomos de oxígeno. Por lo tanto, podemos calcular su masa molar de la siguiente manera:
Masa molar del ácido acético = (2 × masa del carbono) + (4 × masa del hidrógeno) + (2 × masa del oxígeno)
Masa molar del ácido acético = (2 × 12.01 g/mol) + (4 × 1.01 g/mol) + (2 × 16.00 g/mol)
Masa molar del ácido acético = 60.052 g/mol
Importancia de conocer la masa molar del ácido acético
Conocer la masa molar del ácido acético es fundamental en diversas aplicaciones.
¡Así que ahí lo tienes! Calcular la masa molar del ácido acético puede ser un dolor de cabeza, pero no te preocupes, ¡ya sabes cómo hacerlo! Recuerda que conocer la masa molar es fundamental para poder llevar a cabo reacciones químicas y preparar tus deliciosos aderezos para ensaladas. Así que, ¡adelante, químicos culinarios! ¡A calcular y cocinar se ha dicho!










Post Comment