Entendiendo el número de oxidación: concepto clave en química
El número de oxidación, ese misterioso concepto que puede resultar todo un enigma para muchos estudiantes de química. En este artículo desentrañaremos su significado y su importancia en las reacciones químicas, permitiéndote comprender de forma clara y sencilla uno de los pilares fundamentales de esta ciencia. ¡Prepárate para iluminar tu mente con este fascinante tema!
Entendiendo el concepto de número de oxidación: ¿Qué es y cómo se calcula?
El número de oxidación es un número entero que representa la carga real o aparente de un átomo en un compuesto, asumiendo que los electrones compartidos en un enlace covalente se asignan por completo al átomo más electronegativo. Este concepto es fundamental en química, ya que nos ayuda a comprender cómo los átomos ganan, pierden o comparten electrones en una reacción química.
Para calcular el número de oxidación de un átomo en un compuesto, se siguen algunas reglas generales:
- Los elementos en su forma elemental tienen un número de oxidación de 0, como el oxígeno O2 o el nitrógeno N2.
- Los iones monoatómicos tienen un número de oxidación igual a su carga, por ejemplo, el Na+ tiene un número de oxidación de +1.
- El flúor en los compuestos siempre tiene un número de oxidación de -1.
- El oxígeno en la mayoría de los compuestos tiene un número de oxidación de -2, excepto en peróxidos donde es -1.
- El hidrógeno generalmente tiene un número de oxidación de +1, excepto en hidruros metálicos donde es -1.
Para calcular el número de oxidación de un elemento en un compuesto, se deben considerar estas reglas y ajustar las cargas para que se sumen a la carga total del compuesto. Es importante recordar que el número de oxidación es una convención y no representa la realidad física de la distribución de electrones en un enlace químico.
Explorando la definición de oxidación: un proceso químico fundamental
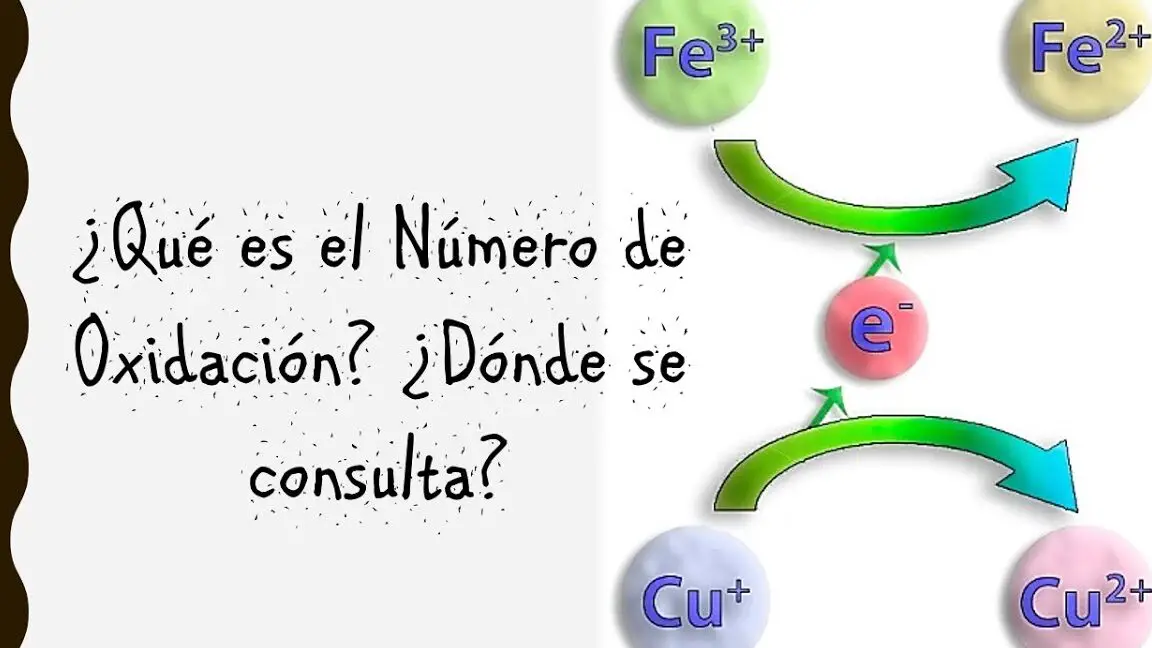
La oxidación es un proceso químico fundamental en el cual un compuesto cede electrones. Este fenómeno puede ser fácilmente observado en la vida cotidiana, como por ejemplo, cuando el hierro se oxida y forma óxido de hierro, más conocido como herrumbre.
¿Qué es la oxidación?
La oxidación es la pérdida de electrones por parte de un átomo, molécula o ion durante una reacción química. Este proceso está estrechamente relacionado con la reducción, ya que usualmente ocurren de forma simultánea en lo que se conoce como reacciones redox.
¿Cómo se representa la oxidación?
En las reacciones químicas, la oxidación se representa mediante la pérdida de electrones. Por ejemplo, en la oxidación del hierro, el átomo de hierro pierde electrones para formar iones férricos, lo que resulta en la formación de óxido de hierro.
Ejemplos de oxidación en la vida cotidiana:
- La oxidación de los metales, como el hierro, para formar óxidos metálicos.
- La oxidación de los alimentos durante su metabolismo en el cuerpo humano.
- La oxidación de los hidrocarburos en la combustión, liberando energía en forma de calor y luz.
El proceso de asignación de números de oxidación: una guía completa
El proceso de asignación de números de oxidación es fundamental en la química para determinar cómo los electrones se transfieren en una reacción química. Aquí tienes una guía completa sobre este tema:
- ¿Qué son los números de oxidación?: Los números de oxidación son valores que se asignan a los átomos en compuestos químicos para ayudar a determinar cómo se comparten o transfieren los electrones en una reacción.
- Reglas generales:
- El número de oxidación de un elemento puro es siempre 0.
- El número de oxidación de un ion monoatómico es igual a la carga del ion.
- En compuestos, el número de oxidación de un elemento es determinado por reglas específicas según su posición en la tabla periódica.
- Aplicaciones:
- Los números de oxidación son útiles para equilibrar ecuaciones químicas.
- Ayudan a determinar qué especie se oxida y cuál se reduce en una reacción redox.
- Métodos para asignar números de oxidación:
Método Descripción Razonamiento químico Analizar la estructura de la molécula y las reglas generales para asignar números de oxidación. Reglas específicas Seguir reglas específicas según el tipo de elemento y su posición en la tabla periódica. - Errores comunes:
- Confundir la carga de un ion con su número de oxidación.
- No considerar las excepciones a las reglas generales.
¡Y hasta aquí la odisea de los números de oxidación! Ahora ya puedes fardar con tus amigos de lo que sabes sobre química y dejarlos con la boca abierta. ¡A por todas, químico en potencia!













Post Comment