La variación periódica de las propiedades químicas
La variación periódica de las propiedades químicas es un fenómeno fascinante que nos permite comprender cómo los elementos interactúan entre sí. En este artículo, exploraremos cómo los elementos de la tabla periódica exhiben patrones predecibles en su comportamiento químico. Desde la electronegatividad hasta el radio atómico, descubriremos cómo estas propiedades cambian de manera sistemática a medida que avanzamos en la tabla. ¡Prepárate para sumergirte en el mundo de la química y desentrañar los misterios de la variación periódica de las propiedades químicas!
Qué es la variacion periodica en química
La variación periódica de las propiedades químicas
La variación periódica de las propiedades químicas se refiere al patrón repetitivo en el que ciertas propiedades de los elementos químicos varían de manera predecible a medida que se desplazan a lo largo de la tabla periódica. Estas propiedades incluyen el tamaño atómico, la energía de ionización, la electronegatividad y la afinidad electrónica, entre otras.
El concepto de variación periódica se basa en la estructura electrónica de los átomos. Cada elemento tiene una configuración electrónica única, que determina la forma en que interactúa con otros elementos y cómo sus propiedades cambian a lo largo de la tabla periódica.
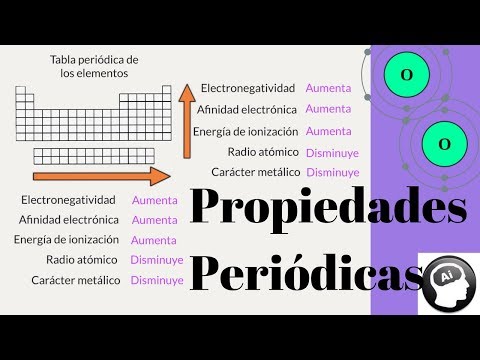
Uno de los ejemplos más conocidos de variación periódica es el tamaño atómico. A medida que se desplaza de izquierda a derecha en un período de la tabla periódica, el tamaño de los átomos disminuye. Esto se debe a que a medida que se agregan más protones al núcleo atómico, la atracción hacia los electrones externos aumenta, lo que reduce el tamaño del átomo. Por otro lado, a medida que se desplaza hacia abajo en un grupo de la tabla periódica, el tamaño atómico aumenta debido a la adición de capas electrónicas.
Otra propiedad que exhibe variación periódica es la energía de ionización, que es la energía requerida para eliminar un electrón de un átomo neutro. En general, la energía de ionización tiende a aumentar de izquierda a derecha en un período y disminuye de arriba abajo en un grupo. Esto se debe a que a medida que se desplaza hacia la derecha en un período, los átomos se vuelven más pequeños y la atracción entre el núcleo y los electrones aumenta, lo que requiere más energía para eliminar un electrón. Por otro lado, a medida que se desplaza hacia abajo en un grupo, los electrones se encuentran en capas de energía más alejadas del núcleo, lo que disminuye la atracción y la energía de ionización.
La electronegatividad es otra propiedad química que muestra variación periódica. La electronegatividad es la capacidad de un átomo para atraer electrones en un enlace químico. Al igual que la energía de ionización, la electronegatividad tiende a aumentar de izquierda a derecha en un período y disminuye de arriba abajo en un grupo.
Cómo varía las propiedades periódicas
La variación periódica de las propiedades químicas
La tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite organizar y clasificar los elementos de manera sistemática. Uno de los aspectos más interesantes de la tabla periódica es la variación periódica de las propiedades químicas de los elementos.
Cuando observamos la tabla periódica, podemos notar que las propiedades de los elementos varían de manera regular a medida que nos desplazamos de izquierda a derecha en un período y de arriba a abajo en un grupo. Esta variación periódica está relacionada con la estructura electrónica de los átomos.
La variación de las propiedades periódicas se debe principalmente a la variación en el número de electrones en la capa de valencia de los elementos. La capa de valencia es la última capa electrónica y determina las propiedades químicas de un elemento.
Un ejemplo claro de la variación periódica de las propiedades químicas es el tamaño atómico. En general, el tamaño atómico disminuye a medida que nos desplazamos de izquierda a derecha en un período. Esto se debe a que a medida que se añaden electrones a la capa de valencia, la carga nuclear efectiva aumenta, lo que atrae a los electrones con mayor fuerza y reduce el tamaño del átomo.
Otra propiedad periódica importante es la electronegatividad. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. En general, la electronegatividad aumenta a medida que nos desplazamos de izquierda a derecha en un período y disminuye a medida que nos desplazamos de arriba a abajo en un grupo. Esto se debe a que a medida que se añaden electrones a la capa de valencia, el átomo se vuelve más electronegativo.
La variación periódica de las propiedades químicas también se refleja en otras propiedades como la energía de ionización, la afinidad electrónica y la conductividad eléctrica. En cada caso, la variación periódica está relacionada con la estructura electrónica de los átomos y la forma en que los electrones se distribuyen en las capas.
Qué son la propiedades periódicas de los elementos químicos
La variación periódica de las propiedades químicas
Las propiedades químicas de los elementos, como su reactividad, capacidad de formar compuestos o estabilidad, no son constantes y varían de manera periódica a lo largo de la tabla periódica. Estas variaciones se conocen como propiedades periódicas de los elementos químicos.
Uno de los aspectos más importantes de las propiedades periódicas es el tamaño atómico. El tamaño de un átomo está determinado por su radio atómico, que es la distancia desde el núcleo hasta la capa más externa de electrones. En general, el tamaño atómico disminuye de izquierda a derecha en un periodo y aumenta de arriba hacia abajo en un grupo. Esto se debe a la atracción entre los electrones y el núcleo, así como al efecto de apantallamiento de los electrones internos.
La electronegatividad es otra propiedad periódica que describe la capacidad de un átomo para atraer electrones en un enlace químico. Los elementos con alta electronegatividad tienden a atraer más electrones, mientras que los elementos con baja electronegatividad son menos atractivos para los electrones. Esta propiedad también varía de izquierda a derecha en un periodo y disminuye de arriba hacia abajo en un grupo.
La energía de ionización es otra propiedad periódica importante. Esta medida indica la energía necesaria para arrancar un electrón de un átomo neutro. En general, la energía de ionización aumenta de izquierda a derecha en un periodo y disminuye de arriba hacia abajo en un grupo. Los elementos con alta energía de ionización tienen una mayor atracción por sus electrones y son menos propensos a perderlos.
La afinidad electrónica es otra propiedad periódica que describe la tendencia de un átomo de ganar electrones. Los elementos con alta afinidad electrónica tienen una mayor capacidad para aceptar electrones, mientras que los elementos con baja afinidad electrónica son menos propensos a ganar electrones. Al igual que otras propiedades periódicas, la afinidad electrónica varía de izquierda a derecha en un periodo y disminuye de arriba hacia abajo en un grupo.
¡Así que ahí lo tienes, amigos! La variación periódica de las propiedades químicas es como un baile cósmico en el que los elementos se ponen a menear sus electrones al ritmo de la tabla periódica. Es como si cada elemento tuviera su propio estilo de baile, algunos son tímidos y se quedan en su lugar, mientras que otros son los reyes de la pista y se lanzan a bailar con cualquiera. Pero al final del día, todos están ahí, moviéndose al compás de la química. ¡Viva la fiesta química!













Post Comment