Todo lo que debes saber sobre el átomo: Guía completa
El átomo es la unidad básica de la materia, y su estudio es fundamental para comprender el mundo que nos rodea. En esta guía completa, te llevaremos a través de todo lo que debes saber sobre el átomo, desde su estructura hasta su comportamiento en distintas situaciones. Si alguna vez te has preguntado cómo funciona el mundo en su nivel más fundamental, esta guía es para ti.
- Cuáles son los 7 modelos atómicos
- Modelo atómico de Dalton
- Modelo atómico de Thomson
- Modelo atómico de Rutherford
- Modelo atómico de Bohr
- Modelo atómico de Sommerfeld
- Modelo atómico de Schrödinger
- Modelo atómico actual
- Cuáles son las 5 partes del átomo
- 1. Núcleo
- 2. Electrones
- 3. Capas o niveles de energía
- 4. Orbitales
- 5. Carga eléctrica
Cuáles son los 7 modelos atómicos
El átomo ha sido objeto de estudio desde la antigüedad y a lo largo de la historia se han desarrollado diversos modelos atómicos en un intento por comprender su estructura y comportamiento. En este artículo te presentaremos los 7 modelos atómicos más importantes que han surgido a lo largo de la historia.
Modelo atómico de Dalton
John Dalton propuso en 1803 el primer modelo atómico moderno, en el que se consideraba al átomo como una esfera sólida e indivisible. Según esta teoría, los átomos de un mismo elemento eran idénticos y los átomos de diferentes elementos eran diferentes en masa y tamaño.
Modelo atómico de Thomson
En 1897, J.J. Thomson descubrió el electrón y propuso un nuevo modelo atómico en el que consideraba al átomo como una esfera de carga positiva en la que se encontraban incrustados los electrones. Este modelo es conocido como el modelo del «pastel de pasas».
Modelo atómico de Rutherford
En 1911, Ernest Rutherford llevó a cabo el famoso experimento de la lámina de oro y descubrió que la carga positiva del átomo se concentraba en un núcleo central y que los electrones giraban alrededor del mismo. Este modelo atómico se conoce como el modelo planetario.
Modelo atómico de Bohr
En 1913, Niels Bohr propuso un modelo atómico en el que los electrones giraban alrededor del núcleo en órbitas fijas y definidas, y sólo podían ocupar ciertos niveles de energía. Este modelo atómico fue muy importante en el desarrollo posterior de la física cuántica.
Modelo atómico de Sommerfeld
Arnold Sommerfeld amplió el modelo de Bohr en 1916, incluyendo órbitas elípticas y subniveles de energía dentro de cada nivel. Este modelo atómico permitió explicar con mayor precisión la estructura de los átomos y sus espectros de emisión.
Modelo atómico de Schrödinger
En 1926, Erwin Schrödinger desarrolló una ecuación matemática que describía el comportamiento de los electrones en un átomo. Este modelo atómico se basaba en la teoría de la mecánica cuántica y permitió explicar con mayor precisión la estructura de los átomos y sus propiedades.
Modelo atómico actual
El modelo atómico actual es una combinación de los modelos atómicos anteriores y se basa en la teoría cuántica. Según este modelo, el átomo se compone de un núcleo central que contiene protones y neutrones, rodeado por electrones que se mueven en órbitas definidas y que tienen una alta probabilidad de encontrarse en ciertas regiones del espacio conocidas como «orbitales».
Cuáles son las 5 partes del átomo
El átomo es la unidad básica de la materia, y está compuesto por diferentes partes que lo conforman. En este artículo, vamos a hablar de las 5 partes principales del átomo.
1. Núcleo
El núcleo es la parte central del átomo, y está compuesto por protones y neutrones. Los protones tienen carga positiva, mientras que los neutrones no tienen carga. El número de protones en el núcleo determina el elemento químico al que pertenece el átomo.
2. Electrones
Los electrones son partículas con carga negativa que orbitan alrededor del núcleo en diferentes capas o niveles de energía. Su número y distribución en estas capas determinan las propiedades químicas del átomo.
3. Capas o niveles de energía
Los electrones se organizan en diferentes capas o niveles de energía alrededor del núcleo. El nivel más cercano al núcleo tiene menor energía y puede contener un número máximo de 2 electrones, mientras que los niveles más alejados del núcleo tienen mayor energía y pueden contener hasta 8 electrones.
4. Orbitales
Los orbitales son regiones del espacio alrededor del núcleo donde es más probable encontrar los electrones. Cada orbital puede contener un máximo de 2 electrones con espines opuestos.
5. Carga eléctrica
El átomo en su conjunto tiene carga neutra, ya que el número de protones en el núcleo es igual al número de electrones en las capas exteriores. Sin embargo, si se añaden o eliminan electrones, el átomo se convierte en un ion con carga eléctrica positiva o negativa, respectivamente.
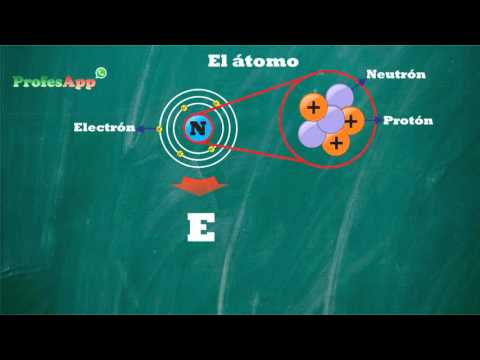
Qué es un átomo y cuáles son sus partes
Un átomo es la unidad básica de la materia, compuesta por un núcleo central y electrones que orbitan alrededor del mismo. El núcleo está formado por protones y neutrones, mientras que los electrones se encuentran en la nube electrónica.
Los protones tienen carga positiva, los electrones tienen carga negativa y los neutrones no tienen carga. La cantidad de protones en el núcleo determina el tipo de átomo, es decir, su número atómico. Por otro lado, la cantidad de protones y neutrones juntos determina la masa atómica del átomo.
La distribución de los electrones en los diferentes niveles de energía de la nube electrónica está determinada por la configuración electrónica del átomo, que a su vez está influenciada por el número de electrones y la carga nuclear efectiva.
Los átomos pueden unirse entre sí para formar moléculas a través de enlaces químicos. Estos enlaces pueden ser covalentes, iónicos o metálicos, y se forman cuando los átomos comparten, pierden o ganan electrones para alcanzar una configuración electrónica más estable.
En resumen, el átomo es la unidad básica de la materia compuesta por protones, neutrones y electrones, y su estructura determina las propiedades químicas y físicas de los elementos y compuestos.
En conclusión, el átomo es una unidad fundamental en la química y la física, y su comprensión es esencial para entender cómo funciona el mundo que nos rodea. Desde su descubrimiento, los científicos han trabajado arduamente para desentrañar sus misterios y han llegado a conclusiones sorprendentes que han cambiado nuestra comprensión del universo. Esperamos que esta guía completa haya sido útil para comprender mejor los aspectos básicos del átomo y cómo funciona.










Post Comment